摘要:18.某同学用1mol·L-1CuSO4溶液2ml和0.5 mol·L-1NaOH溶液4ml混合,然后加入35%的甲醛溶液0.5ml.但该同学加热到沸腾都未见有红色沉淀生成.经分析是因为试剂用量不当造成的实验失败.该同学使用不当的是 A.硫酸铜的用量太少 B.氢氧化钠的用量太少 C.甲醛的浓度太大 D. 硫酸铜的浓度太小
网址:http://m.1010jiajiao.com/timu3_id_364893[举报]
某同学用10mol?L-1 的浓盐酸配制250mL 1mol?L-1 的稀盐酸,并进行有关实验.请回答下列问题:
(1)需要量取浓盐酸
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
(3)实验室中所用少量氯气用下列方法制取:4HCl(浓)+MnO2
Cl2↑+MnCl2+2H2O.
试回答下列问题:
该反应中
查看习题详情和答案>>
(1)需要量取浓盐酸
25.0
25.0
mL.(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
250mL容量瓶
250mL容量瓶
、胶头滴管
胶头滴管
.(3)实验室中所用少量氯气用下列方法制取:4HCl(浓)+MnO2
| ||
试回答下列问题:
该反应中
MnO2
MnO2
是氧化剂,氧化产物是Cl2
Cl2
.若产生标准状况下的Cl222.24L,则被氧化的HCl0.2
0.2
mol.在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下,请回答下列问题: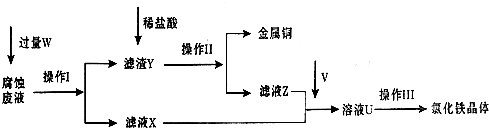
(1)请写出FeCl3溶液与铜反应的离子方程式:
(2)操作Ⅱ之前最好加入适量稀盐酸,某同学用10mol?L-1 的浓盐酸配制250mL 1mol?L-1 的稀盐酸,并进行有关实验.
①需要量取浓盐酸
②配制该稀盐酸时除量筒、烧杯、玻璃棒外,还必须用到的仪器有
③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视
(3)操作Ⅲ前需要通入气体V,请写出实验室制取气体V的化学方程式:
(4)操作Ⅲ应在HCl气流氛围中进行,其原因是
(5)若通入的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(6)若向氯化铁溶液中加入一定量石灰水,调节溶液pH,可得红褐色沉淀.该过程中调节溶液的pH为5,则金属离子浓度为
查看习题详情和答案>>

(1)请写出FeCl3溶液与铜反应的离子方程式:
2Fe3++Cu═2Fe2++Cu2+
2Fe3++Cu═2Fe2++Cu2+
;操作Ⅰ加入的试剂W是铁粉或Fe
铁粉或Fe
.(2)操作Ⅱ之前最好加入适量稀盐酸,某同学用10mol?L-1 的浓盐酸配制250mL 1mol?L-1 的稀盐酸,并进行有关实验.
①需要量取浓盐酸
25mL
25mL
mL.②配制该稀盐酸时除量筒、烧杯、玻璃棒外,还必须用到的仪器有
250mL容量瓶
250mL容量瓶
、胶头滴管
胶头滴管
.③用已知浓度的氢氧化钠溶液滴定稀盐酸,滴定过程中眼睛应注视
锥形瓶内溶液颜色的变化
锥形瓶内溶液颜色的变化
,实验时未用标准液润洗滴定管,测得锥形瓶中待测液的浓度大于
大于
实际浓度.(填“>”、“<”或“=”).(3)操作Ⅲ前需要通入气体V,请写出实验室制取气体V的化学方程式:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
,该反应中
| ||
MnO2
MnO2
是氧化剂.(4)操作Ⅲ应在HCl气流氛围中进行,其原因是
抑制Fe3+(或FeCI3)的水解
抑制Fe3+(或FeCI3)的水解
.(5)若通入的V的量不足,则最后制得的氯化铁晶体不纯净,这是因为溶液U中含有杂质
FeCl2或Fe2+
FeCl2或Fe2+
.请设计合理的实验,验证溶液U中的成分,并判断通入的V的量是否不足取少量溶液U,加入几滴KSCN溶液,溶液显红色,则表明溶液U中有Fe3+(FeCl3);另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液退色,则表明溶液U中有Fe2+(或FeCl2),说明通入的V的量不足够若KMnO4溶液不退色,则说明通入的V的量充足
取少量溶液U,加入几滴KSCN溶液,溶液显红色,则表明溶液U中有Fe3+(FeCl3);另取少量溶液U,加入几滴酸性KMnO4溶液,若KMnO4溶液退色,则表明溶液U中有Fe2+(或FeCl2),说明通入的V的量不足够若KMnO4溶液不退色,则说明通入的V的量充足
(简要说明实验步骤、现象和结论).供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水.
(6)若向氯化铁溶液中加入一定量石灰水,调节溶液pH,可得红褐色沉淀.该过程中调节溶液的pH为5,则金属离子浓度为
4.0×10-11mol?L-1
4.0×10-11mol?L-1
.(己知:Ksp[Fe(OH)3]=4.0×10-38)某同学用10mol?L-1的浓盐酸配制250mL 1mol?L-1的稀盐酸,并进行有关实验.请回答下列问题:
(1)需要量取浓盐酸
(2)配制该稀盐酸时使用的仪器有
(3)定容时应在
(4)取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为
查看习题详情和答案>>
(1)需要量取浓盐酸
25.0
25.0
mL.(2)配制该稀盐酸时使用的仪器有
30
30
mL量筒(量筒可供选择的规格有10mL.,30mL,50mL,100mL)、烧杯、玻璃棒,还必须用到的玻璃仪器有250mL容量瓶
250mL容量瓶
、胶头滴管
胶头滴管
.(3)定容时应在
液面距离刻度线1~2cm时
液面距离刻度线1~2cm时
处改用胶头滴管
胶头滴管
(实验仪器)滴加至溶液凹液面与刻度线水平相切
溶液凹液面与刻度线水平相切
.(4)取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为
2.6
2.6
克,设反应后溶液的体积仍为100mL,则反应后溶液中的氢离子的物质的量浓度为0.2mol/L
0.2mol/L
.某同学用10mol/L的浓盐酸配制250mL 1mol/L的稀盐酸,并进行有关实验.请回答下列问题:
(1)需要量取浓盐酸
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
(3)取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为
查看习题详情和答案>>
(1)需要量取浓盐酸
25
25
mL.(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有
胶头滴管
胶头滴管
、250mL容量瓶
250mL容量瓶
等.(3)取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为
2.6
2.6
g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为0.2mol/L
0.2mol/L
.(12分)某同学用10mol? L-1 的浓盐酸配制250mL 1mol? L-1 的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸____________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有________________、___________。
(3)实验室中所用少量氯气用下列方法制取:4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O。
Cl2↑+MnCl2+2H2O。
试回答下列问题:
该反应中_____________是氧化剂,氧化产物是_______________。
若产生标准状况下的Cl2 2.24L,则被氧化的HCl__________mol。