摘要:5.假设我们的世界从三维变为二维.则改变后的元素周期表第2周期有 种元素. 第Ⅴ题 下图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去).已知D是一种盐.焰色反应呈紫色.E在常温下是黄绿色气体.F是一种能使品红溶液褪色的无色气体. 请回答下列问题:
网址:http://m.1010jiajiao.com/timu3_id_364515[举报]
在两支试管中分别加入3 mL同浓度的稀盐酸,将两个各装有0.3 g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3粉末同时倒入试管中,(如图2-2),观察反应现象:
(1)通过观察发生的现象是:____________________________________________________。
(2)上述实验所用的稀盐酸浓度未知,反应完成后,你能判断甲、乙两支试管哪一支用的是NaHCO3粉末____________________。
结合化学方程式中各物质之间反应的量的关系从三种不同情况说明理由:_______________
_____________________________________________________________________。
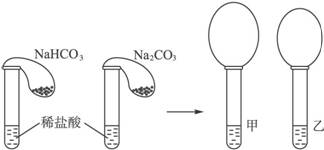
图2-2
(3)利用上述方法还可以少量制取多种气体,请说出四种:_______________、_____________、________________、_________________。(说明所用试剂和制取的气体)
查看习题详情和答案>>《联合国气候变化框架公约》是世界上第一个为全面控制二氧化碳等温室气体排放,以应对全球气候变暖给人类经济和社会带来不利影响的国际公约.各国科学家们也加强了对CO2创新利用的研究.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把 二氧化碳从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇等.“绿色自由”构想技术流程如下:

Ⅰ.二氧化碳的吸收
(1)上述流程中“循环”的意义为
(2)吸收池中不用饱和碳酸钠溶液代替饱和碳酸钾溶液可能的原因是
Ⅱ.二氧化碳的利用
(1)2009年我国二氧化碳排放总量约为6.6×109吨,若采用上述流程将二氧化碳转化成甲醇(假设CO2的吸收率为80%,转化率为90%),通过计算确定理论上可制得甲醇多少吨?
(2)工业上常将甲醇加入汽油,制成利于改善城市环境的甲醇汽油.
已知常温下甲醇、汽油及一氧化碳的燃烧热如下:
1mol等物质的量的甲醇、汽油(C8H18)混合的燃料,在一定量的氧气中燃烧,放出热量2980kJ,则反应中生成CO
查看习题详情和答案>>

Ⅰ.二氧化碳的吸收
(1)上述流程中“循环”的意义为
提供碳酸钾的利用率
提供碳酸钾的利用率
.(2)吸收池中不用饱和碳酸钠溶液代替饱和碳酸钾溶液可能的原因是
相同条件下,在水中溶解度碳酸钾大于碳酸钠
相同条件下,在水中溶解度碳酸钾大于碳酸钠
.(已知:碳酸钾、碳酸钠的价格分别为:5200元/吨、2300元/吨.)Ⅱ.二氧化碳的利用
(1)2009年我国二氧化碳排放总量约为6.6×109吨,若采用上述流程将二氧化碳转化成甲醇(假设CO2的吸收率为80%,转化率为90%),通过计算确定理论上可制得甲醇多少吨?
(2)工业上常将甲醇加入汽油,制成利于改善城市环境的甲醇汽油.
已知常温下甲醇、汽油及一氧化碳的燃烧热如下:
| 物质 | 甲醇 | 汽油(C8H8) | 一氧化碳 |
| 燃烧热/kJ?mol-l | 725 | 5518 | 283 |
0.5
0.5
mol.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C是同一周期相邻的三种元素,B、D、F元素原子最外电子层的p能级(轨道)上的电子均处于半满状态,元素E的最高正价氧化物的水化物在同周期元素的最高正价氧化物的水化物中酸性最强.
请回答下列问题:
(1)A、B、C三元素的第一电离能由大到小的顺序为 (用对应的元素符号填空,下空同),三者的电负性由大到小的顺序为
(2)A、B、C三元素的氢化物分子的空间结构分别是
(3)B、D、F三元素的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是 .
(4)F元素原子基态时的核外电子排布式为 .
(5)由B、E两种元素组成的化合物X,常温下为易挥发的淡黄色液体,x分子为三角锥形分子,且分子里B、E两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质,则X分子的电子式为 ,X分子的中心原子的杂化轨道类型为 ,X与水反应的化学方程式是 .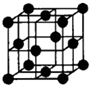
(6)另有一种位于周期表中ds区的元素G,该元素单质形成的晶体晶胞如图所示,若假设该原子半径为r,相对原子质量为Mr,则该元素单质的密度可表示为 .(用NA表示阿伏加德罗常数)
查看习题详情和答案>>
请回答下列问题:
(1)A、B、C三元素的第一电离能由大到小的顺序为
(2)A、B、C三元素的氢化物分子的空间结构分别是
(3)B、D、F三元素的氢化物的沸点从高到低排列次序是(填化学式)
(4)F元素原子基态时的核外电子排布式为
(5)由B、E两种元素组成的化合物X,常温下为易挥发的淡黄色液体,x分子为三角锥形分子,且分子里B、E两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质,则X分子的电子式为

(6)另有一种位于周期表中ds区的元素G,该元素单质形成的晶体晶胞如图所示,若假设该原子半径为r,相对原子质量为Mr,则该元素单质的密度可表示为