摘要:25.(1)3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O (2)0.025 (3)0.005 0.005 (4)0.005<x<0.015
网址:http://m.1010jiajiao.com/timu3_id_364321[举报]
氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料.为探究氨气的性质,某研究性学习小组做了以下实验:
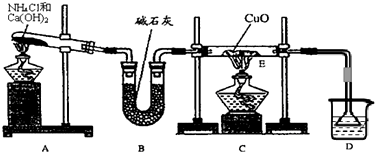
(1)实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气.
①实验室制取氨气的化学方程式为 .
②若用加热碳酸氢铵固体制取纯净的氨气,你认为装置中U型管的作用是 .
(2)在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有 性.
(3)某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O.已知:①Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+.
②在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2.
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O.(简述操作方法、现象和结论)
(4)现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体.下列有关说法正确的是【已知:3Cu2O+14HNO3(稀)═6Cu(NO3)2+2NO↑+7H2O】 :
A.加入NaOH溶液的体积为1.2L
B.Cu和Cu2O混合物质量为27.2g
C.混合物完全溶解后溶液中n(H+)=0.3mol
D.将等质量混合物完全还原至少需标准状况下H21.12L. 查看习题详情和答案>>

(1)实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气.
①实验室制取氨气的化学方程式为
②若用加热碳酸氢铵固体制取纯净的氨气,你认为装置中U型管的作用是
(2)在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有
(3)某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O.已知:①Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+.
②在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2.
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O.(简述操作方法、现象和结论)
(4)现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体.下列有关说法正确的是【已知:3Cu2O+14HNO3(稀)═6Cu(NO3)2+2NO↑+7H2O】
A.加入NaOH溶液的体积为1.2L
B.Cu和Cu2O混合物质量为27.2g
C.混合物完全溶解后溶液中n(H+)=0.3mol
D.将等质量混合物完全还原至少需标准状况下H21.12L. 查看习题详情和答案>>
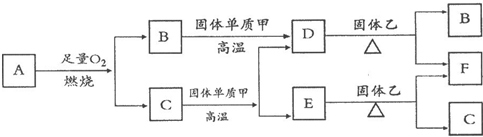
I.气体A只含X、Y两种短周期元素且A分子的空间构型为直线型,最简式为XY气体.常温下B、D、E是常见无色气体,C是无色液体.各物质有如图所示的转化关系.
试回答下列问题:
(1)写出A化学式
(2)D与固体乙反应过程中,观察到固体乙由黑色变为红色,则乙为
(3)C与黑色固体单质甲在高温下反应的化学方程式为:
(4)F的一种氧化物(与F相同颜色)能与KMnO4溶液反应,生成物中含两种不溶于水的常见物质(不同类型的物质,其中一种常用作催化剂),请写出该反应的化学方程式:
II.某研究性学习小组探究铁盐的性质和用途.他们查阅资料知道,可以用铁盐溶解洗涤做过银镜反应实验的试管,原理是:Fe3++Ag(s) Fe2++Ag+,请回答下列问题:
Fe2++Ag+,请回答下列问题:
(1)该小组研究了含有相同物质的量浓度的Fe3+的FeCl3和Fe2(SO4)3两种溶液,哪种溶液洗涤效果更好.如果用相同体积的上述两种溶液,你认为
(2)甲同学提出,Fe(NO3)3溶液也可以做洗涤剂,但乙同学认为用Fe(NO3)3溶液做洗涤剂会产生一种红褐色沉淀和一种有毒气体.请写出该反应的离子方程式
(3)乙同学认为向做过银镜反应实验的试管中的溶液里加入几块铅笔芯也有利于除去银.你认为他的理由是
查看习题详情和答案>>
试回答下列问题:
(1)写出A化学式
C2H2
C2H2
(2)D与固体乙反应过程中,观察到固体乙由黑色变为红色,则乙为
CuO
CuO
(写化学式).(3)C与黑色固体单质甲在高温下反应的化学方程式为:
C+H2O(g)
CO+H2
| ||
C+H2O(g)
CO+H2
.
| ||
(4)F的一种氧化物(与F相同颜色)能与KMnO4溶液反应,生成物中含两种不溶于水的常见物质(不同类型的物质,其中一种常用作催化剂),请写出该反应的化学方程式:
3Cu2O+2KMnO4+7H20=2MnO2+6Cu(OH)2+2KOH或3Cu2O+2KMnO4+H20=2MnO2+6CuO+2KOH
3Cu2O+2KMnO4+7H20=2MnO2+6Cu(OH)2+2KOH或3Cu2O+2KMnO4+H20=2MnO2+6CuO+2KOH
.II.某研究性学习小组探究铁盐的性质和用途.他们查阅资料知道,可以用铁盐溶解洗涤做过银镜反应实验的试管,原理是:Fe3++Ag(s)
 Fe2++Ag+,请回答下列问题:
Fe2++Ag+,请回答下列问题:(1)该小组研究了含有相同物质的量浓度的Fe3+的FeCl3和Fe2(SO4)3两种溶液,哪种溶液洗涤效果更好.如果用相同体积的上述两种溶液,你认为
FeCl3
FeCl3
溶液洗涤效果更好,作出该判断的依据是因为AgCl溶解度比Ag2SO4小,加入FeCl3溶液更有利
因为AgCl溶解度比Ag2SO4小,加入FeCl3溶液更有利
.(2)甲同学提出,Fe(NO3)3溶液也可以做洗涤剂,但乙同学认为用Fe(NO3)3溶液做洗涤剂会产生一种红褐色沉淀和一种有毒气体.请写出该反应的离子方程式
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
(3)乙同学认为向做过银镜反应实验的试管中的溶液里加入几块铅笔芯也有利于除去银.你认为他的理由是
3Ag+4H++NO3-═3Ag++NO↑+2H2O
3Ag+4H++NO3-═3Ag++NO↑+2H2O

(2008?安庆模拟)某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
【实验1】:如图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细.电解开始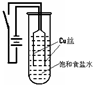 30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10.随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色.
30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10.随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色.
【实验2】:将实验1中试管底部的橙黄色沉淀取出,分装在两支小试管中,以后的操作和现象如下:
阅读资料:常见铜的化合物颜色如下:
请回答下列问题:(1)铜的常见正化合价为
(2)阳极上发生的反应为:
(3)写出实验2中①、②的离子方程式①
查看习题详情和答案>>
【实验1】:如图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细.电解开始
 30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10.随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色.
30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10.随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色.【实验2】:将实验1中试管底部的橙黄色沉淀取出,分装在两支小试管中,以后的操作和现象如下:
| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸溶液 | 沉淀溶解,有无色气泡产生,最终得到蓝色溶液. |
| ② | 滴入稀硫酸溶液 | 橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜(不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色或橙黄色 | 氯化亚铜 | 白色 |
+1、+2
+1、+2
,最终试管底部橙黄色沉淀的化学式Cu2O
Cu2O
;(2)阳极上发生的反应为:
2Cu+2Cl--2e-=2CuCl↓
2Cu+2Cl--2e-=2CuCl↓
;(3)写出实验2中①、②的离子方程式①
3Cu2O+2H++2NO3-=6Cu2++2NO↑+7H2O
3Cu2O+2H++2NO3-=6Cu2++2NO↑+7H2O
②Cu2O+2H+=Cu+Cu2++H2O
Cu2O+2H+=Cu+Cu2++H2O
.氧化还原反应中实际上包含氧化和还原两个过程,下面是一个还原过程的反应式:NO3-+4H++3e-→NO↑+2H2O.
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种物质(甲)能使上述还原过程发生.请回答:
(1)写出该氧化还原反应的化学方程式(不必配平)
(2)反应中硝酸表现出
(3)反应中若产生4.48L(标准状况)气体,则转移电子的物质的量是
(4)硝酸浓度不同,与甲反应的产物不同.若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是
查看习题详情和答案>>
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种物质(甲)能使上述还原过程发生.请回答:
(1)写出该氧化还原反应的化学方程式(不必配平)
3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O
3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O
:(2)反应中硝酸表现出
酸性
酸性
、氧化性
氧化性
的性质.(3)反应中若产生4.48L(标准状况)气体,则转移电子的物质的量是
0.6
0.6
mol.(4)硝酸浓度不同,与甲反应的产物不同.若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是
使用较浓的硝酸,产物中有部分NO2
使用较浓的硝酸,产物中有部分NO2
:Fe2O3、Cu2O都是红色粉末,常用作颜料.某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
(1)查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.溶于稀硝酸会生成NO写出Cu2O 溶于稀硝酸的化学反应方程式:
(2)提出假设:假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O假设3:
设计探究实验:
限选试剂:稀硫酸、稀硝酸、KSCN 溶液、NaOH溶液、高锰酸钾溶液、新制氯水、Fe屑
查看习题详情和答案>>
(1)查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.溶于稀硝酸会生成NO写出Cu2O 溶于稀硝酸的化学反应方程式:
3Cu2O+14HNO3=6Cu(NO3)2+7H2O+2NO↑
3Cu2O+14HNO3=6Cu(NO3)2+7H2O+2NO↑
(2)提出假设:假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O假设3:
红色粉末是Fe2O3和Cu2O的混合物
红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:
限选试剂:稀硫酸、稀硝酸、KSCN 溶液、NaOH溶液、高锰酸钾溶液、新制氯水、Fe屑
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量粉末于试管中,加入足量的稀硝酸,振荡,溶解,分为A、B两支试管,在A试管中滴加1~2滴 KSCN 溶液,观察. | |
| 2 | ||
| … |