网址:http://m.1010jiajiao.com/timu3_id_364318[举报]
 (2013?深圳一模)水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084% CaO.从中提取钴的主要工艺流程如下:
(2013?深圳一模)水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084% CaO.从中提取钴的主要工艺流程如下:

(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图1所示.考虑生产成本和效率,最佳的浸出时间为
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+H2O+Na2CO3=Na2Fe6(SO4)4(OH)12↓+Na2SO4+CO2↑
(3)“除钙、镁”的原理反应为:
MgSO4+2NaF=MgF2↓+Na2SO4;CaSO4+2NaF=CaF2↓+Na2SO4已知KSP(CaF2)=1.11×10-10,KSP(MgF2)=7.40×10-11,加入过
量NaF溶液反应完全后过滤,则滤液中
| c(Ca2+) |
| c(Mg2+) |
(4)“沉淀”中含杂质离子主要有SO42-、F-、
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图2所示).电池反应为LiCoO2+C6
| 充电 |
| 放电 |
实验仪器:研钵、250mL烧杯、100mL量筒、电子天平
实验药品:复方氢氧化铝、盐酸雷尼替丁、0.05mol/L盐酸、蒸馏水
实验过程:
实验一:
①称量1.000g研磨后的复方氢氧化铝放入烧杯中,加入75mL蒸馏水搅拌使药品溶解;
②向溶液中缓慢滴入0.05mol/L盐酸,不断搅拌并测量溶液的pH;
③至测量的pH在3.00时,且30s内基本不变停止滴加,记录读数,重复滴定两次;
④将药品换成1.000g盐酸雷尼替丁重复上述步骤.
实验数据如下:
| 复方氢氧化铝 | 盐酸雷尼替丁 | |||
| 滴定前 | 滴定后 | 滴定前 | 滴定后 | |
| 1 | 0.01 | 79.8 | 0.02 | 18.6 |
| 2 | 0.00 | 79.5 | 0.03 | 19.0 |
| 3 | 0.03 | 80.5 | 0.00 | 18.7 |
①在烧杯中加入0.05mol/L盐酸50mL;
②在溶液中加入1.000g复方氢氧化铝粉末,不断搅拌,计时并同时记录pH读数的变化;
③将复方氢氧化铝粉末换成盐酸雷尼替丁重复上述步骤.
实验数据如下:
| 时间(min) | 0 | 0.5 | 1 | 1.5 | 2 | 2.5 | 3 | 3.5 | 4 | 5 |
| 复方氢氧化铝 | 3.53 | 3.62 | 3.70 | 3.75 | 3.79 | 3.84 | 3.88 | 3.89 | 3.90 | 3.92 |
| 盐酸雷尼替丁 | 1.72 | 1.65 | 1.60 | 1.55 | 1.74 | 1.80 | 1.84 | 1.87 | 1.87 | 1.88 |
| 时间(min) | 10 | 15 | 20 | 25 | 30 | 35 | 40 | |||
| 复方氢氧化铝 | 3.97 | 4.01 | 4.12 | 4.13 | 4.14 | 4.15 | 4.15 | |||
| 盐酸雷尼替丁 | 1.88 | 1.87 | 1.88 |
(1)完成上述实验还缺少的仪器有
(2)用盐酸雷尼替丁进行实验二时,0~1.5min内pH减小的原因是:
(3)请你根据上述实验,得出合理的实验结论:
①
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。
已知:①氧化性: >Fe3+>I2;还原性:
>Fe3+>I2;还原性: >I-;②KI+I2
>I-;②KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有 (用离子符号表示),蓝色的沉淀是_______(用化学式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为:______、______
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:_________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质不适合作为食盐加碘剂,其理由是_________________________________。
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
|
|
0.01mol·L-1KIO3 酸性溶液(含淀粉) 的体积/mL |
0.01mol·L-Na2SO3 溶液的体积/mL |
H2O的 体积/mL |
实验 温度 /℃ |
溶液出现 蓝色时所 需时间/s |
|
实验1 |
5 |
V1 |
35 |
25 |
t1 |
|
实验2 |
5 |
5 |
40 |
25 |
t2 |
|
实验3 |
5 |
5 |
V2 |
0 |
t3 |
表中数据:t1 t2(填“>”、“<”或“=”);表中V2=___________mL
查看习题详情和答案>>
[化学——选修有机化学基础](15分)
柠檬酸三丁酯(TBC)是绿色环保的增塑剂,应用极其广泛,它的结构式如左下图,
已知柠檬酸的结构简式为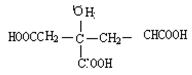 ,1—丙醇的键线式可表示为
,1—丙醇的键线式可表示为
试回答:
(1)TBC的分子式为 ,在研究TBC的结构时要用到一种谱图(如下),用于推测 等信息,它是 图(填序号);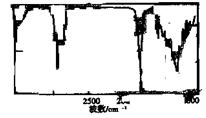
A.核磁共振氢谱 B.红外光谱 C.质谱
(2)1—丁醇在一定条件下可生成1—丁醇,反应类型为 ,化学方程式为 ,TBC在该条件下 (填“能”或“不能”)生成含醛基的化合物;
(3)柠檬酸与甲醇反应生成柠檬酸三甲酯的化学方程式 ;
(4)合成TBC时,不同条件对酯化学率的影响如下表:
| n(酸):n(醇) | 1:5.0 | 1:5.5 | 1:6.0 | 1:6.5 | 1:7.0 |
| 酯化率/% | 95.1 | 96.3 | 97.0 | 97.4 | 97.2 |
| 时间/h | 0.5 | 1.0 | 2.0 | 3.0 | 5.0 |
| 酯化率/% | 40.0 | 70.2 | 94.3 | 97.4 | 97.4 |
| 温度/°C | 130 | 140 | 145 | 150 | 160 |
| 酯化率/% | 89.5 | 96.2 | 97.4 | 97.4 | 97.2 |
A.1:5,1h,130° B.1:5.5,1h,140°C
C.1:7,2h,160°C D.1:6.5,3h,145°C
(5)TBC与足量NaOH溶液反应的化学方程式: 。 查看习题详情和答案>>
(12分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生现象明显比通入CO2快。
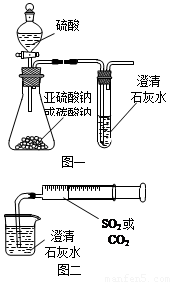
(1)对比分析两组实验,你认为用图一装置实验
时,通入SO2不能出现浑浊的原因可能是:
_________________。
(2)用图二装置实验时,以相同速率通入CO2或
SO2,SO2产生浑浊、澄清的现象比CO2
快的原因是______________________________________。
(3)用图一进行SO2与石灰水反应的实验时,从安全角度
考虑装置应做何改进?
_____________________________________________。
(4)有人提出上述实验现象“石灰水先变浑浊再澄清”可能与澄清石灰水的浓度有关。为了探究CO2通入澄清石灰水中的实验现象,查得下列数据:
Ⅰ 20℃时,Ca(OH)2 的溶解度为:0.165g/100g水。
Ⅱ 不同浓度石灰水生成CaCO3的最大量
|
饱和石灰水与水的体积比 |
1:0 |
1:1 |
1:2 |
1:3 |
1:5 |
1:7 |
|
能生成CaCO3的最大量(g/100水) |
A |
0.110 |
0.073[来源:Zxxk.Com] |
0.055 |
0.037 |
0.028 |
① 上表中A= g/100g水
Ⅲ 在1.01×105Pa CO2压力下,CaCO3的溶解度
|
热力学温度/K |
282 |
298 |
308 |
|
CaCO3溶解度(g/100水)[来源:学#科#网Z#X#X#K] |
0.130 |
0.094 |
0.076 5 |
Ⅳ 在不同压强(CO2)下,CaCO3溶解度(18℃)
|
P(CO2)/Pa |
0 |
1.40×104 |
9.95×104 |
|
CaCO3溶解度(g/100水) |
0.001 3 |
0.023 3 |
0.108 6 |
认真分析以上数据回答下列问题:
②由表Ⅲ和表Ⅳ可知CaCO3溶解度的变化规律是:
③由以上数据可以得出结论:欲观察到“石灰水先变浑浊再澄清的现象”,所需要的实验条件是:
查看习题详情和答案>>