网址:http://m.1010jiajiao.com/timu3_id_363743[举报]
| 3 |
| 2 |
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1,则上述合成反应中a=
(2)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为
(3)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a
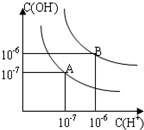 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:(1)则25℃时水的电离平衡曲线应为
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的 pH=7,则NaOH溶液与H2SO4溶液的体积比为
(3)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.请分析其原因:
(4)25℃时,以酚酞为指示剂用0.1mol/L的NaOH标准溶液滴定未知浓度的HCl溶液,则:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则HCl溶液浓度
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积
③当达到滴定终点时现象
(Ⅰ)(6分)现有下列物质: ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(Ⅱ)(4分)
某化学实验小组探究市售食用白醋中醋酸的的准确浓度,取25.00mL某品牌食用白
醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)左图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,
A处的刻度为25,滴定管中液面读数应为 mL。
(2)为了减小实验误差,该同学一共进行了三次实验,假设每次
所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实
验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,
其原因可能是 。
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第一次滴定用的锥形瓶未润洗
D.滴定结束时,俯视读数
(3)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= 。
(Ⅲ)(15分)
已知:在25时H2OH++OH- KW=10-14 CH3COOH
H++ CH3COO- Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)
的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将
(填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠
的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系
为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)若由pH=3的HA溶液V1mL与pH=11的NaOH{溶液V2 mL。混合而得,则下列说法不正确的是____________。
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(7)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中
能生成沉淀,原因是
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= 。
查看习题详情和答案>>
I.恒温、恒压下,在一个可变容积K*s^5#u的容器中发生如下发应:A(气)+B(气)![]() C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时AK*s^5#u的物质K*s^5#u的量
为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成CK*s^5#u的物质K*s^5#u的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和CK*s^5#u的物质K*s^5#u的量分别是ymol和3a mol,则x= mol,y= mol。平衡时,BK*s^5#u的物质K*s^5#u的量
(甲) >2 mol (乙)=2 mol (丙)< 2 mol (丁)可能大于、等于或小于2mol
(4)若在(3)K*s^5#u的平衡混合物中再加入3molC,待再次到达平衡后,CK*s^5#u的物质K*s^5#u的量分数是 。
(5)若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定K*s^5#u的容器中发生上述反应。开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中K*s^5#u的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和bK*s^5#u的大小
(6) A(气)+B(气)![]() C(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新K*s^5#u的平衡时,BK*s^5#u的浓度是原来K*s^5#u的60%,则
C(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新K*s^5#u的平衡时,BK*s^5#u的浓度是原来K*s^5#u的60%,则
A.平衡向正反应方向移动了 B.物质AK*s^5#u的转化率增大了
C.物质BK*s^5#u的质量分数增加了 ![]() 混合气体K*s^5#u的平均相对分子质量减少了
混合气体K*s^5#u的平均相对分子质量减少了
II. 某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
一级电离:H2A![]() H++HA- 二级电离:HA-
H++HA- 二级电离:HA-![]() H++A2-
H++A2-
已知相同浓度时K*s^5#u的电离度a(H2A)>d(HA-),设有下列四种溶液:
A.0.01mol.L-1K*s^5#u的H2A溶液 B.0.01mol.L-1K*s^5#u的NaHA溶液
C.0.01mol.L-1K*s^5#u的HCl与0.04mol.L-1K*s^5#u的NaHA溶液等体积混合液
D.0.02mol.L-1K*s^5#u的NaOH与0.02 mol.L-1K*s^5#u的NaHA溶液等体积混合液
![]()
![]() 据此,填写下列空白(填代号)
据此,填写下列空白(填代号)
(1) c(H+)最大K*s^5#u的是__________,最小K*s^5#u的是__________。
(2) c(H2A)最大K*s^5#u的是_________,最小K*s^5#u的是__________
(3) c(A2-)最大K*s^5#u的是___________, 最小K*s^5#u的是________。
查看习题详情和答案>>Ⅰ.大多数的化学反应都是可逆反应。
在一个容积为2.0L的固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) ![]() 3C(g)。向容器中加入2.0molA和6.0 molB,当反应进行到2min时达到平衡,此时生成了3.0molC。
3C(g)。向容器中加入2.0molA和6.0 molB,当反应进行到2min时达到平衡,此时生成了3.0molC。
(1)用B的浓度变化来表示的反应速率u(B)=____。该反应在此条件下的化学平衡常数K=____(结果用分数表示)。
(2)在相同实验条件下,若在同一容器中加入2.0molA和8.0molB,若要求平衡后C在反应混合气中体积分数不变,则还应加入C ____mol。
(3)在相同实验条件下,若在同一容器中加入3.0molA和一定量的B,平衡时C的物质的量为3.0mol,则加入的B的物质的量为____mol
Ⅱ.在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合,所得溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是( )
A.c(HA)<c(A―) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A―) D.c(OH―)=c(H+)+![]() [c(HA)一c(A―)]
[c(HA)一c(A―)]
(2)常温下,在20mL0.1mol/L![]() 溶液中逐滴加入0.1mol/L HCI溶液40mL,溶液中含碳元素的各种微粒(
溶液中逐滴加入0.1mol/L HCI溶液40mL,溶液中含碳元素的各种微粒(![]() 因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。
因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。

回答下列问题:
①在同一溶液中,![]() ,、
,、![]() 、
、![]() (填:“能”或“不能”)____大量共存。
(填:“能”或“不能”)____大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是:____
③已知在![]() 时,
时,![]() 水解反应的平衡常数即水解常数
水解反应的平衡常数即水解常数
![]() ,当溶液中c(
,当溶液中c(![]() ):c(
):c(![]() )=2:1时,溶液的pH:___。
)=2:1时,溶液的pH:___。