摘要:5.为除去SO2中混有的少量SO3.并使所得物质的平均相对分子质量尽可能地增大.应选用的物质是----------------------------- A.亚硫酸钠溶液 B.饱和亚硫酸氢钠溶液 C.碱石灰 D.浓硫酸
网址:http://m.1010jiajiao.com/timu3_id_363648[举报]
[Ⅰ] 硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验由废铁屑(含Fe2O3)制备FeSO4·7H2O晶体过程如下: (铁屑先用Na2CO3溶液洗涤去除了油污)
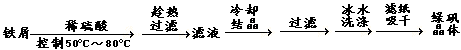
(1)铁屑溶解时发生主要反应的离子方程式____________________________
(2)有关制备中的分析错误的是_______
①铁屑需过量放可除去产生的Fe3+且利于防止产生Fe3+;②趁热过滤目的是加快过滤速度;③硫酸过稀致使溶液浓度过低不利于晶体大量析出;④冰水洗涤能减少晶体的溶解损失;⑤控制温度50)C~80)C利于制成饱和溶液,加速铁屑的溶解;
(3)检验滤液中是否含有的Fe3+方法是_____________________________________
 [Ⅱ]硫酸最古老工业生产方法是“铅室法”:以绿矾为原料,在铅制蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O
[Ⅱ]硫酸最古老工业生产方法是“铅室法”:以绿矾为原料,在铅制蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O![]() Fe2O3+SO3↑+SO2↑+14H2O↑。抽出混合气体冷凝便得到浓硫酸。
Fe2O3+SO3↑+SO2↑+14H2O↑。抽出混合气体冷凝便得到浓硫酸。
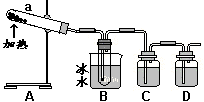
用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和SO2。
(4)① 试管b中得到的主要产物是___________,
② 为检验SO2生成物,试管c中应加入的试剂
是__________
③ B中所得硫酸的理论浓度(溶质的质量分数)为_________
(5)这一古老的制备方法被淘汰,除原料有限和能耗较高还可能原因有____________
查看习题详情和答案>>