摘要:理解原子的组成及同位素的概念.掌握原子序数.核电荷数.质子数.中子数.核外电子数.以及质量数与质子数.中子数之间的相互关系.
网址:http://m.1010jiajiao.com/timu3_id_363454[举报]
常温下,一种烷烃A和一种烯烃B组成的混合气体,B分子中最多只有4个碳原子,且B分子的碳原子个数比A分子的多。
(1)将1L该混合气体充分燃烧,在同温、同压下得到2.5L CO2 气体。试推断原混合气体中A和B可能的组成及体积比。
(1)将1L该混合气体充分燃烧,在同温、同压下得到2.5L CO2 气体。试推断原混合气体中A和B可能的组成及体积比。

(2)120℃时,取1L该混合气体与9L O2混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大6.25%,试通过计算确定A和B的分子式
查看习题详情和答案>>
X、Y、Z、Q、T五种元素位于前四周期,且原子序数依次增大.X、Y的单质在常温常压下呈气态,X形成的单质分子中无孤电子对,Y的基态原子中能级上有两个未成对电子.Z原子的半径在同周期主族元素中最大.Q的氧化物是形成酸雨的一种主要物质.T2+所含有的电子数等于Z原子与Q原子的电子数之和.
(1)Q元素位于元素周期表第 周期 族,T2+的电子排布式为 .
(2)Y元素和Q元素分别形成的组成相似的氢化物中,沸点最高的是 .(写出化学式)原因是 .用惰性电极电解X、Y、Z三种元素形成的化合物水溶液,其阳极的电极反应式为 .
(3)Z与Q形成的化合物的水溶液呈 (填“酸性”、“中性”、“碱性”)原因是 (用离子方程式表示)
(4)已知在25℃、101325Pa时:
2T(s)+Q(s)=T2Q(s)△H=-79.5KJ/mol
Q(s)+Y2(g)=QY2(g)△H=-296.6KJ/mol
根据上述反应,请写出T2Q与Y2反应生成T与QY2的热化学方程式 .
查看习题详情和答案>>
(1)Q元素位于元素周期表第
(2)Y元素和Q元素分别形成的组成相似的氢化物中,沸点最高的是
(3)Z与Q形成的化合物的水溶液呈
(4)已知在25℃、101325Pa时:
2T(s)+Q(s)=T2Q(s)△H=-79.5KJ/mol
Q(s)+Y2(g)=QY2(g)△H=-296.6KJ/mol
根据上述反应,请写出T2Q与Y2反应生成T与QY2的热化学方程式
下表中所列的是8种短周期元素原子的半径及主要化合价:
(1)C元素在周期表中的位置为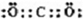
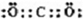 ,G元素最低价氢化物的空间构型为
,G元素最低价氢化物的空间构型为
(2)B、D、E所代表元素的离子半径从大到小的顺序为
(3)C与E形成的化合物属于
(4)周期表中有些元素存在“对角线相似”现象(一种元素的性质常同它右下方相邻的另一种元素具有类似性),请写出A的单质与强碱溶液反应的离子方程式:
(5)有人认为:H-E键的键能大于H-L键的键能,所以H2E的沸点高于H2L的沸点.你是否赞同这种观点
查看习题详情和答案>>
| 元素代号 | A | B | C | D | E | G | L | I |
| 原子半径/nm | 0.111 | 0.064 | 0.117 | 0.16 | 0.066 | 0.070 | 0.104 | 0.077 |
| 主要化合价 | +2 | -1 | +4,-4 | +2 | -2 | +5.-3 | +6,-2 | +4,-4 |
第三周期ⅣA族
第三周期ⅣA族
;IE2的电子式为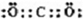
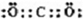
三角锥型
三角锥型
.(2)B、D、E所代表元素的离子半径从大到小的顺序为
O2->F->Mg2+
O2->F->Mg2+
(填离子符号).G、C最高价氧化物对应水化物的酸性强弱关系为(写化学式)HNO3>H2SiO3
HNO3>H2SiO3
.(3)C与E形成的化合物属于
原子
原子
晶体.(4)周期表中有些元素存在“对角线相似”现象(一种元素的性质常同它右下方相邻的另一种元素具有类似性),请写出A的单质与强碱溶液反应的离子方程式:
Be+2OH-═BeO22-+H2↑
Be+2OH-═BeO22-+H2↑
.(5)有人认为:H-E键的键能大于H-L键的键能,所以H2E的沸点高于H2L的沸点.你是否赞同这种观点
不赞同
不赞同
(填“赞同”或“不赞同”),理由:H2O与H2S所成晶体为分子晶体,H2O的熔沸点高于H2S的熔沸点与键能无关
H2O与H2S所成晶体为分子晶体,H2O的熔沸点高于H2S的熔沸点与键能无关
.