题目内容
某元素只存在两种同位素,且在自然界中含量相近,其相对原子质量为152.0原子核外电子数为63。下列叙述中错误的是( )
A.它是副族元素 B.它是第六周期元素
C.它的原子核内有63个质子 D.它的一种同位素有89个中子
【答案】
D
【解析】元素的相对原子质量,是按照元素各种核素原子所占的一定百分比算出的平均值。若两种同位素的质量数分别是A1和 A2,则该元素的相对原子质量是A1×0.5+ A2×0.5=152.0,解得A1+ A2=304.0。因为该元素原子的核外电子数是63,所以这两种同位素的中子数之和为304-63-63=178。所以选项D是不正确的。因为63-2-8-8-18-18=9,所以原子序数为63的元素应该位于第六周期,第ⅢB镧系元素。答案是D。

练习册系列答案
相关题目
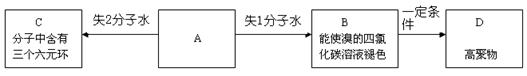
 _,反应类型:__________________;
_,反应类型:__________________;