摘要:27.A.B.C是由H.O.Na三种元素组成的三种化合物.甲.乙.丙是三种单质.分别由上述元素组成.上述单质和化合物之间存在如下反应关系: 据此推断 (1)化合物A.B.C分别是A B C (2)甲.乙.丙分别是甲 乙 丙
网址:http://m.1010jiajiao.com/timu3_id_363346[举报]
 A、B、C是由H、O、Na三种元素中的两种或三种元素组成的三种化合物,其中化合物A为淡黄色固体.甲、乙、丙是三种单质,分别由上述元素组成.上述单质和化合物之间存在如图反应关系:
A、B、C是由H、O、Na三种元素中的两种或三种元素组成的三种化合物,其中化合物A为淡黄色固体.甲、乙、丙是三种单质,分别由上述元素组成.上述单质和化合物之间存在如图反应关系:据此推断
(1)化合物A、B、C分别是(用化学式表示):A
Na2O2
Na2O2
;BH2O
H2O
;CNaOH
NaOH
.(2)甲、乙、丙分别是(写名称):甲
钠
钠
;乙氧气
氧气
;丙氢气
氢气
.(3)写出化合物A与化合物B反应,生成单质乙和化合物C的反应方程式:
2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2H2O═4NaOH+O2↑
. A、B、C是由H、O、Na三种元素组成的三种化合物.甲、乙、丙是三种单质,分别由上述元素组成.上述单质和化合物之间存在如下反应关系:据此推断(写化学式)
A、B、C是由H、O、Na三种元素组成的三种化合物.甲、乙、丙是三种单质,分别由上述元素组成.上述单质和化合物之间存在如下反应关系:据此推断(写化学式)(1)化合物A、B、C分别是A
Na2O2
Na2O2
BH2O
H2O
CNaOH
NaOH
(2)甲、乙、丙分别是甲
Na
Na
乙O2
O2
丙H2
H2
.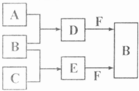 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).试回答:
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).试回答:(1)E的结构式是
O=C=O
O=C=O
,F的电子式是

(2)写出F与D反应的离子方程式并标出电子转移的方向和数目


(3)物质Z与B互为同素异形体,它常用于对空气进行杀菌、净化和水果保鲜等.Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是
O3+2H++2I-=O2+I2+H2O
O3+2H++2I-=O2+I2+H2O
.(4)取0.3mol F与足量D充分混合后,再通入0.4mol E恰好完全被吸收,所得溶液中各种离子的浓度由大到小的顺序是
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
.已知A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大.A、C同主族,可形成离子化合物CA;B、D同主族,可形成DB2、DB3两种分子.请回答下列问题:
(1)元素E在元素周期表中的位置是
(2)A、B两种元素能形成两种常温下呈液态的化合物M、N,具有强氧化性的化合物M的电子式可表示为
 ;化合物N在同主族元素形成有具有相同结构的物质中,具有较高的沸点,其原因是
;化合物N在同主族元素形成有具有相同结构的物质中,具有较高的沸点,其原因是
(3)在上述元素最高价氧化物对应的水化物中酸性最强的是
(4)A、B、C、D中的三种或四种元素能形成多种离子化合物,其中水溶液呈酸性的有
查看习题详情和答案>>
(1)元素E在元素周期表中的位置是
第三周期ⅦA族
第三周期ⅦA族
,A、B、C、D、E五种元素原子半径由小到大的顺序为H<O<Cl<S<Na
H<O<Cl<S<Na
(用元素符号书写).(2)A、B两种元素能形成两种常温下呈液态的化合物M、N,具有强氧化性的化合物M的电子式可表示为


水分子间存在氢键
水分子间存在氢键
.(3)在上述元素最高价氧化物对应的水化物中酸性最强的是
HClO4
HClO4
(写化学式,下同),非金属气态氢化物还原性最强的是H2S
H2S
.(4)A、B、C、D中的三种或四种元素能形成多种离子化合物,其中水溶液呈酸性的有
NaHSO4、NaHSO3
NaHSO4、NaHSO3
(写出所有化合物,用化学式表示,下同),能与稀盐酸发生氧化还原反应的有Na2S2O3
Na2S2O3
.下表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
(1)A~E中,属于烃的是
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为
(3)C催化氧化生成D的化学方程式为
(4)有机物B具有的性质是
①无色无味的溶液;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是
查看习题详情和答案>>
| A | ①能使溴的四氯化碳溶液褪色 ②比例模型如图  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成 ②球棍模型如图  |
| C | ①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2 ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊试液变红 |
(1)A~E中,属于烃的是
AB
AB
(填字母).(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为
CH2=CH2+Br2→CH2BrCH2Br
CH2=CH2+Br2→CH2BrCH2Br
.(3)C催化氧化生成D的化学方程式为
2CH3CH2OH+O2
2CH3CHO+2H2O
| Cu |
| △ |
2CH3CH2OH+O2
2CH3CHO+2H2O
.| Cu |
| △ |
(4)有机物B具有的性质是
②③
②③
(填序号).①无色无味的溶液;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色.
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是
2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O
2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O
(用化学方程式说明).