网址:http://m.1010jiajiao.com/timu3_id_363314[举报]
(06年上海卷)已知![]() (注:R,R’为烃基)
(注:R,R’为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。

试回答
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性 b.能发生水解反应
(2)A分子中的官能团是 ,D的结构简式是 。
(3)C→D的反应类型是 ,E→F的反应类型是
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(4)写出化学方程式:A→B 。
(5)写出E生成高聚物的化学方程式: 。
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2,写出C2的结构简式:
查看习题详情和答案>>(06年上海卷)已知 可简写为
可简写为 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为:
(1)降冰片烯属于__________。
a.环烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯的分子式为__________________________。
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为
。
(4)降冰片烯不具有的性质 。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
查看习题详情和答案>> 已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.请回答下列问题:
(1)B、C、D三种元素的电负性由大到小的顺序是
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的为
(3)与C同族且位于第四周期元素所形成气态氢化物的电子式为


(4)F的基态原子核外电子排布式是
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能
(6)氢气是理想的清洁能源,X元素与镧(La)元素的合金可作储氢材料,该合金的晶胞如图所示,晶胞中心有一个X原子,其他X原子都在晶胞面上,则该晶体的化学式为
| 3 |
| ||
| 3 |
| ||
(06年北京卷)铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是__________________________。
(2)铝与氢氧化钾溶液反应的离子方程式是__________________________。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
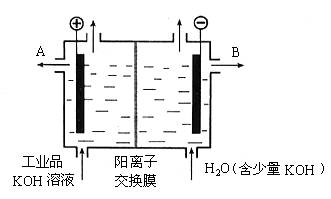
①该电解槽的阳极反应式是__________________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因____________________________
_______________________________________________________________________________________________________________________________________________。
③除去杂质后的氢氧化钾溶液从液化出口_____________(填写“A”或“B”)导出。
查看习题详情和答案>> ①![]() 均与Y的气态氢化物分子具有相同的电子数;
均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物![]() 溶液遇苯酚呈紫色。
溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是_____________。
(2)将![]() 溶液滴入沸水可得到红褐色液体,反应的离子方程式是______________
溶液滴入沸水可得到红褐色液体,反应的离子方程式是______________
______________________________________________,此液体具有的性质是_____________(填写序号字母)。
a. 光束通过该液体时形成光亮的“通路”
b. 插入电极通直流电后,有一极附近液体颜色加深
c. 向该液体中加入硝酸银溶液,无沉淀产生
d. 将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被![]() 氧化放热98.0 kJ。若2 mol该气体与1 mol
氧化放热98.0 kJ。若2 mol该气体与1 mol ![]() 在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为_________。
在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为_________。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有![]() 个电子转移时,该反应的化学方程式是___________________________。
个电子转移时,该反应的化学方程式是___________________________。