网址:http://m.1010jiajiao.com/timu3_id_363297[举报]
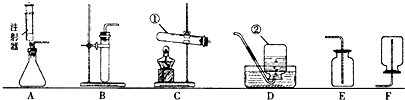
(1)写出标号仪器的名称:①
(2)采用分解过氧化氢溶液与二氧化锰的混合物的方法制取氧气有许多优点,如
①产物无污染 ②不需加热 ③需加热 ④生成物只有氧气
(3)为确定某集气瓶最多可收集氧气的体积,请设计一个简便的测量方法(仪器用品等任选):
(4)甲同学用分解过氧化氢溶液的方法制取并收集氧气,应分别选择装置
(1)已知Mn2+在不同条件下,可被氧化为+4、+6、+7等不同价态,依据题目所给出的数据推算氧化产物中锰元素的化合价为________;
(2)若XeO3是分子晶体,试写出有关的离子方程式:________________。
(3)若将反应后的溶液稀释至90 mL,则稀释后溶液的pH为________。
查看习题详情和答案>>依据题目要求回答下列问题。
(1)常温下,浓度均为 0.l mol·L-1的下列六种溶液的pH如下表:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
①上述盐溶液中的阴离子,结合H+能力最强的是 。
②浓度均为0.0l mol·L-1的下列五种物质的溶液中,酸性最强的是 (填编号);将各溶液分别稀释100倍,pH变化最小的是 (填编号)
A. HCN B. HClO C. C6H5OH D. CH3COOH E. H2CO3
③据上表数据,请你判断下列反应不能成立的是 (填编号)
A. CH3COOH + Na2CO3 = NaHCO3 + CH3COONa
B. CH3COOH + NaCN = CH3COONa + HCN
C. CO2 + H2O + NaClO = NaHCO3 + HClO
D. CO2 + H2O + 2C6H5ONa = Na2CO3 + 2C6H5OH
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为 。
(2)已知常温下Cu(OH)2的Ksp=2×10—20。又知常温下某CuSO4溶液里 c(Cu2+)=0.02mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于_ 。
查看习题详情和答案>>
(14分)依据题目要求回答下列问题。
(1)常温下,浓度均为0.lmol·L-1的下列六种溶液的pH如下表:
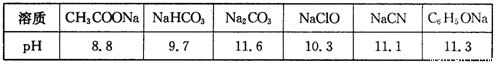
①上述盐溶液中的阴离子,结合H+能力最强的是
②根据表中数据,浓度均为0.0lmol·L-1的下列五种物质的溶液中,酸性最强的是 (填编号);将各溶液分别稀释100倍,pH变化最小的是 (填编号)
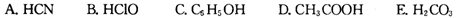
③据上表数据,请你判断下列反应不能成立的是 (填编号)
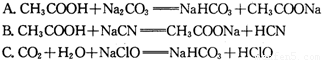
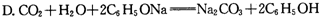
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为 。
(2)已知常温下 。又知常温下某CuSO4溶液里
。又知常温下某CuSO4溶液里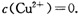
02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于____.
(3)已知可逆反应 是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:

①写出该反应平衡常数的表达式:____ 。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度
(选填“增大”“减小”或“不变”);当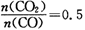 ,混合气体平均相对分子质量为
。
,混合气体平均相对分子质量为
。
查看习题详情和答案>>
(14分)依据题目要求回答下列问题。
(1)常温下,浓度均为0.lmol·L-1的下列六种溶液的pH如下表: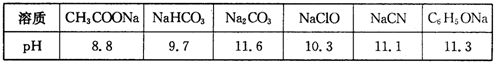
①上述盐溶液中的阴离子,结合H+能力最强的是
②根据表中数据,浓度均为0.0lmol·L-1的下列五种物质的溶液中,酸性最强的是 (填编号);将各溶液分别稀释100倍,pH变化最小的是 (填编号)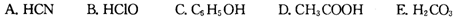
③据上表数据,请你判断下列反应不能成立的是 (填编号)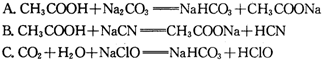

④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为 。
(2)已知常温下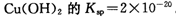 。又知常温下某CuSO4溶液里
。又知常温下某CuSO4溶液里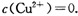
02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于____.
(3)已知可逆反应 是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
①写出该反应平衡常数的表达式:____ 。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度 (选填“增大”“减小”或“不变”);当 ,混合气体平均相对分子质量为 。
,混合气体平均相对分子质量为 。