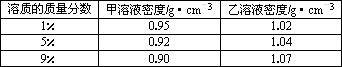
摘要:已知甲.乙溶质质量分数与密度的关系如下表: 溶质质量分数 甲溶液密度(g/cm3) 乙溶液密度(g/cm3) 1% 0.95 1.02 5% 0.92 1.04 10% 0.90 1.07 甲物质的1%的溶液与9%的溶液等体积混合.乙物质的1%的溶液与9%的溶液等体积混合后.下列叙述正确的是 A.混合后甲.乙溶液质量分数均大于5% B.混合后乙溶液质量分数大于5%.甲溶液质量分数小于5% C.混合后甲溶液质量分数大于5%.乙溶液质量分数小于5% D.混合后甲.乙溶液质量分数均等于5%
网址:http://m.1010jiajiao.com/timu3_id_363074[举报]
已知甲、乙溶质质量分数与密度的关系如下表:
溶质质量分数 | 甲溶液密度(g/cm3) | 乙溶液密度(g/cm3) |
1% | 0.95 | 1.02 |
5% | 0.92 | 1.04 |
10% | 0.90 | 1.07 |
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合后,下列叙述正确的是
A.混合后甲、乙溶液质量分数均大于5%
B.混合后乙溶液质量分数大于5%,甲溶液质量分数小于5%
C.混合后甲溶液质量分数大于5%,乙溶液质量分数小于5%
D.混合后甲、乙溶液质量分数均等于5%
查看习题详情和答案>>|
已知甲、乙溶质的质量分数与溶液密度的关系如下表所示:
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合,下列叙述中,正确的是 | |
| [ ] | |
A. |
混合后,甲、乙溶液中溶质的质量分数均大于5% |
B. |
混合后,乙溶液中溶质的质量分数大于5%,甲溶液中溶质的质量分数小于5% |
C. |
混合后,甲溶液中溶质的质量分数大于5%,乙溶液中溶质的质量分数小于5% |
D. |
混合后,甲、乙溶液中溶质的质量分数均等于5% |
|
已知甲、乙溶质的质量分数与溶液密度的关系如下表所示:
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合,下列叙述中,正确的是 | |
| [ ] | |
A. |
混合后,甲、乙溶液中溶质的质量分数均大于5% |
B. |
混合后,甲溶液中溶质的质量分数大于5%,乙溶液中溶质的质量分数小于5% |
C. |
混合后,乙溶液中溶质的质量分数大于5%,甲溶液中溶质的质量分数小于5% |
D. |
混合后,甲、乙溶液中溶质的质量分数均等于5% |
下表为长式周期表的一部分,其中的编号代表对应的元素.
(1)写出上表中元素⑨原子的外围电子排布式
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:
(3)按要求完成下列各题
a.第一电离能:元素④
b.与元素④所形成的单质互为等电子体的分子、离子的化学式
c.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
d.由X与氧气、KOH溶液构成原电池,负极会产生元素④的单质.则其负极反应式为
(4)由元素③和⑧形成的液态化合物Z,是非极性的直线形分子.0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为
(5)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:
(6)元素⑩所形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 已知该原子的半径为d,相对原子质量为M,NA代表阿伏加德罗常数,请回答:
晶体中该原子的配位数为
(用字母表示)
查看习题详情和答案>>
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
| ⑨ | ⑩ |
3d54s1
3d54s1
.(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:
sp2
sp2
(3)按要求完成下列各题
a.第一电离能:元素④
>
>
元素⑤(选填“>”、“=”、“<”).b.与元素④所形成的单质互为等电子体的分子、离子的化学式
CO
CO
、C22-
C22-
(各写一种).c.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
2NH3.H2O+3H2O2═N2+8H2O
2NH3.H2O+3H2O2═N2+8H2O
d.由X与氧气、KOH溶液构成原电池,负极会产生元素④的单质.则其负极反应式为
2NH3+6OH--6e-═N2+6H2O
2NH3+6OH--6e-═N2+6H2O
.(4)由元素③和⑧形成的液态化合物Z,是非极性的直线形分子.0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为
CS2(l)+3O2(g)═CO2(g)+2SO2(g)△H=-1075kJ/mol
CS2(l)+3O2(g)═CO2(g)+2SO2(g)△H=-1075kJ/mol
(5)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:
分子之间形成氢键
分子之间形成氢键
.(6)元素⑩所形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 已知该原子的半径为d,相对原子质量为M,NA代表阿伏加德罗常数,请回答:

晶体中该原子的配位数为
12
12
,一个晶胞中包含的原子数目为4
4
;该晶体的密度为| M | ||
4
|
| M | ||
4
|
(16分)下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | ④ | ⑤ | ⑥ | |
| | ⑦ | | | | | | | | | | | | | | ⑧ | | |
| | | | | | ⑨ | | | | | ⑩ | | | | | | | |
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:
(3)按要求完成下列各题
a.第一电离能:元素④ 元素⑤(选填“>”、“=”、“<”)。
b.与元素④所形成的单质互为等电子体的分子、离子的化学式 、 (各写一种)。
c.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________________________
d.由X与氧气、KOH溶液构成原电池,负极会产生元素④的单质。则其负极反应式为_____________________________。
(4)由元素③和⑧形成的液态化合物Z,是非极性的直线形分子。0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。该反应的热化学方程式为_________________________
(5)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是: 。
(6)元素⑩所形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。已知该原子的半径为d,相对原子质量为M,NA代表阿伏加德罗常数,请回答:
晶体中该原子的配位数为 ,一个晶胞中包含的原子数目为 ;该晶体的密度为 (用字母表示)
 查看习题详情和答案>>
查看习题详情和答案>>