网址:http://m.1010jiajiao.com/timu3_id_362931[举报]
| O | 2- 4 |
| O | 2- 3 |
| O | 2- 3 |
| O | 2- 3 |
(1)常温下,向20mL 0.2mol?L-1 H2A溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).请根据图示填空:
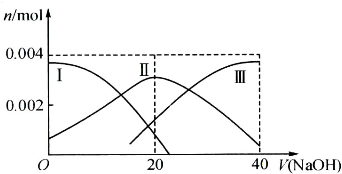
①当V(NaOH)=20mL时,溶液中离子浓度大小关系:
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水
(2)有关H2A的钠盐的热化学方程式如下:
①Na2SO4(s)═Na2S(s)+2O2(g)△H1=+1011.0kJ?mol-1;
②2C(s)+O2(g)═2CO(g)△H2=-221.0kJ?mol-1.
则Na2SO4(s)+4C(s)═Na2S(s)+4CO(g)△H3=
工业上制备Na2S时往往要加入过量的碳,同时还要通入空气,目的有两个,其一是利用碳与氧气反应放出的热维持反应所需温度,其二是
(3)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=
(10分)A―E五种元素中,除A、B外其他均为短周期元素,它们的性质或原子结构如下表:
元素 | 元素性质或原子结构 |
A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
B | 单质为生活中常见的金属,其相对原子质量比A大8 |
C | 地壳中含量最多的金属元素 |
D | 元素的主族序数是其所在周期序数的3倍 |
E | E的某种原子的原子核内没有中子 |
(1)请写出A在元素周期表中的位置 ;C单质在强碱溶液反应的离子方程式是
(2)①在高温条件下,将D、E组成的气态化合物与A的粉末充分反应,生成8gE的单质和 ②A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离 子方程式是 。
子方程式是 。
(3)已知化学反应A+2E+=A2++E2能自发进行,若将上述A、B两种金属,插入含大量E+的电解质溶液的烧杯中,可组成原电池。如图。B为_______极,电极反应式为________
查看习题详情和答案>>(10分)A―E五种元素中,除A、B外其他均为短周期元素,它们的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B | 单质为生活中常见的金属,其相对原子质量比A大8 |
| C | 地壳中含量最多的金属元素 |
| D | 元素的主族序数是其所在周期序数的3倍 |
| E | E的某种原子的原子核内没有中子 |
(1)请写出A在元素周期表中的位置 ;C单质在强碱溶液反应的离子方程式是 。
![]() (2)①在高温条件下,将D、E组成的气态化合物与A的粉末充分反应,生成8gE的单质和 ②A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离子方程式是 。
(2)①在高温条件下,将D、E组成的气态化合物与A的粉末充分反应,生成8gE的单质和 ②A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离子方程式是 。
![]() (3)已知化学反应A+2E+=A2++E2能自发进行,若将上述A、
(3)已知化学反应A+2E+=A2++E2能自发进行,若将上述A、
![]() B两种金属,插入含大量E+的电解质溶液的烧杯中,
B两种金属,插入含大量E+的电解质溶液的烧杯中,
![]() 可组成原电池。如图。
可组成原电池。如图。
B为_______极,电极反应式为________
查看习题详情和答案>>