摘要:在密闭容器中加入P.Q进行反应P+S(g).下列说法可以充分说明在恒温下已达到平衡的是 ( ) A.反应容器中压强不随时间变化而变化 B.反应容器中P.Q.R.S四者共存 C.P和S的生成速率相等 D.反应容器中总的物质的量保持不变
网址:http://m.1010jiajiao.com/timu3_id_362914[举报]
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)根据图回答下列问题.
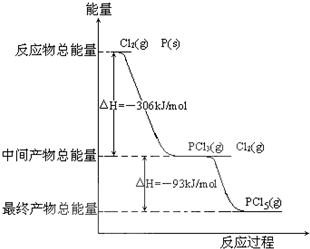
(1)P和Cl2反应生成PCl3的热化学方程式:
(2)PCl5分解生成PCl3和Cl2的热化学方程式:
(3)P和Cl2分两步反应生成1mol PCl5的△H3=
查看习题详情和答案>>

(1)P和Cl2反应生成PCl3的热化学方程式:
P(s)+
Cl2(g)=PCl3(g)△H=-306kJ?mol-1;
| 3 |
| 2 |
P(s)+
Cl2(g)=PCl3(g)△H=-306kJ?mol-1;
;| 3 |
| 2 |
(2)PCl5分解生成PCl3和Cl2的热化学方程式:
PCl5(g)=PCl3(g)+Cl2(g)△H=+93 kJ/mol;
PCl5(g)=PCl3(g)+Cl2(g)△H=+93 kJ/mol;
;温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于25%
25%
(3)P和Cl2分两步反应生成1mol PCl5的△H3=
-399kJ?mol-1;
-399kJ?mol-1;
;P和Cl2一步反应生成1mol PCl5的△H4等于
等于
△H3(填“大于”,“小于”或“等于”).红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).

根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式
(2)PCl5分解成PCl3和Cl2的热化学方程式
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是
(4)P和Cl2分两步反应生成1molPCl5的△H3=
查看习题详情和答案>>

根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式
P(s)+
Cl2(g)═PCl3(g);△H=-306kJ?mol-1
| 3 |
| 2 |
P(s)+
Cl2(g)═PCl3(g);△H=-306kJ?mol-1
.| 3 |
| 2 |
(2)PCl5分解成PCl3和Cl2的热化学方程式
PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ?mol-1
PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ?mol-1
,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于25%
25%
;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2大于
大于
α1(填“大于”、“小于”或“等于”).(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是
两步反应均为放热反应,降低温度有利于提高产率,防止产物分解
两步反应均为放热反应,降低温度有利于提高产率,防止产物分解
.(4)P和Cl2分两步反应生成1molPCl5的△H3=
-399kJ?mol-1
-399kJ?mol-1
.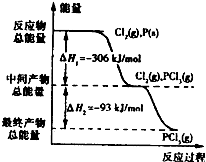 如图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程和能量关系图.其中PCl5(g)分解成PCl3(g)和Cl2(g)的反应是一个可逆反应,温度T℃时,在密闭容器中加入0.6mol PCl5,达平衡时,PCl5还剩0.45mol,其分解率为α,则下列推断不正确的是( )
如图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程和能量关系图.其中PCl5(g)分解成PCl3(g)和Cl2(g)的反应是一个可逆反应,温度T℃时,在密闭容器中加入0.6mol PCl5,达平衡时,PCl5还剩0.45mol,其分解率为α,则下列推断不正确的是( )| A、α等于25% | B、若升高温度,平衡时PCl5的分解率小于α | C、若初始时加入0.6mol PCl3和0.6 mol Cl2,以相同条件进行反应,则平衡时PCl3转化率为3α | D、PCl5分解的热化学方程式为:PCl5(g)?PCl3(g)+Cl2(g)△H=-93kJ?mol-1 |
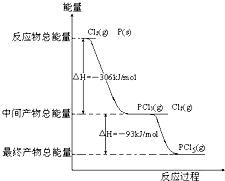 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式
2P(s)+3Cl2(g)=2PCl3(g)△H=-612kJ/mol
2P(s)+3Cl2(g)=2PCl3(g)△H=-612kJ/mol
;(2)PCl5分解生成PCl3和Cl2的热化学方程式
PCl5(g)=PCl3(g)+Cl2(g)△H=+93kJ/mol
PCl5(g)=PCl3(g)+Cl2(g)△H=+93kJ/mol
;上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于
25%
25%
;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2大于
大于
α1(填“大于”,“小于”或“等于”);(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是
因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成
因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成
;(4)P和Cl2分两步反应生成1mol PCl5的△H3=
-399kJ/mol
-399kJ/mol
;P和Cl2一步反应生成1mol PCl5的△H4等于
等于
△H3(填“大于”、“小于”或“等于”),原因是根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的
根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的
. 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是:
P(s)+
Cl2(g)═PCl3(g)△H=-306kJ?mol-1
| 3 |
| 2 |
P(s)+
Cl2(g)═PCl3(g)△H=-306kJ?mol-1
| 3 |
| 2 |
(2)PCl5分解成PCl3和Cl2的热化学方程式是
PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1
PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1
.上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率α1═
25%
25%
;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,则α2大于
大于
α1(填“大于”、“小于”或“等于”);(3)P和Cl2分两步反应生成1mol PCl5的△H3=
-399kJ?mol-1
-399kJ?mol-1
,P和Cl2一步反应生成1mol PCl5的△H4等于
等于
△H3(填“大于”、“小于”或“等于”).