摘要:23.Al3+.AlO2-.Al3+.AlO2-.Al3++3AlO2-+6H2O==4Al(OH)3↓
网址:http://m.1010jiajiao.com/timu3_id_362909[举报]
 (2010?娄底模拟)用AlCl3溶液滴入0.6mol/L的NaOH溶液10mL中,所得到的关系如图所示:
(2010?娄底模拟)用AlCl3溶液滴入0.6mol/L的NaOH溶液10mL中,所得到的关系如图所示:(1)写出各反应的离子方程式
Al3++4OH-=AlO2-+2H2O、3AlO2-+Al3++6H2O=4Al(OH)3↓
Al3++4OH-=AlO2-+2H2O、3AlO2-+Al3++6H2O=4Al(OH)3↓
(2)AlCl3溶液的物质的量浓度
0.1mol/L
0.1mol/L
(3)m点的值.
0.156g
0.156g
.
在Ba(OH)2溶液中逐滴加入KAl(SO4)2溶液,可能发生反应的离子方程式是( )
A.Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+AlO2-+2H2O
B.2Al(OH)3+SO42-+Ba2++2OH-→BaSO4↓+2AlO2-+4H2O
C.Al3++3AlO2-+6H2O→4Al(OH)3↓
D.H++AlO2-+H2O→Al(OH)3↓
查看习题详情和答案>>
A.Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+AlO2-+2H2O
B.2Al(OH)3+SO42-+Ba2++2OH-→BaSO4↓+2AlO2-+4H2O
C.Al3++3AlO2-+6H2O→4Al(OH)3↓
D.H++AlO2-+H2O→Al(OH)3↓
查看习题详情和答案>>
在Ba(OH)2溶液中逐滴加入KAl(SO4)2溶液,可能发生反应的离子方程式是( )
查看习题详情和答案>>
| A.Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+AlO2-+2H2O |
| B.2Al(OH)3+SO42-+Ba2++2OH-→BaSO4↓+2AlO2-+4H2O |
| C.Al3++3AlO2-+6H2O→4Al(OH)3↓ |
| D.H++AlO2-+H2O→Al(OH)3↓ |
(2010?德阳模拟)已知图A-J均为中学化学中常见物质,其中反应①在冶金工业上有重要用途,框图中部分产物已经略去.请回答下列问题:
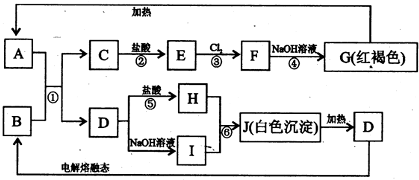
(1)E的电子式为
 .
.
(2)反应①的化学方程式是
(3)反应⑥的离子方程式是
(4)以B、C、NaOH溶液为原料构成原电池,则该电池负极的电极反应式为:
查看习题详情和答案>>

(1)E的电子式为


(2)反应①的化学方程式是
2Al+Fe2O3
2Fe+Al2O3
| ||
2Al+Fe2O3
2Fe+Al2O3
.
| ||
(3)反应⑥的离子方程式是
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.按上图所示制取白色沉淀J,当生成1mol J时,则反应⑤中消耗HCl的物质的量为0.75
0.75
mol.(4)以B、C、NaOH溶液为原料构成原电池,则该电池负极的电极反应式为:
Al+4OH--3e-=AlO2-+2H2O
Al+4OH--3e-=AlO2-+2H2O
.