摘要:(1)从理论上分析.碳原子数不大于10的烷烃分子中.其一氯代物只有一种的烷烃共有 种.它们的结构简式分别是CH4. . (2)含有2个碳原子的氯代烯烃.可能具有同分异构体的条件是 .
网址:http://m.1010jiajiao.com/timu3_id_362782[举报]
(2011?西安模拟)[选修一化学与技术]联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:

(1)沉淀池中发生反应的化学方程式为
(2)X是
(3)Z中除了溶解的氨气、食盐外,其它溶质还有
(4)从理论上分析,在氨碱法生产过程中
(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(6)联碱法中,每当通入NH3 44.8L(已折合成标准状况下)时可以得到纯碱100.0g则NH3的利用率为
查看习题详情和答案>>

(1)沉淀池中发生反应的化学方程式为
NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
;(2)X是
CO2
CO2
,Y是NH3
NH3
(填化学式);(3)Z中除了溶解的氨气、食盐外,其它溶质还有
Na2CO3、NH4Cl
Na2CO3、NH4Cl
;排出液中的溶质除了氢氧化钙外,还有CaCl2、NaCl
CaCl2、NaCl
;(4)从理论上分析,在氨碱法生产过程中
不需要
不需要
(填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为CaCO3+2NaCl═Na2CO3+CaCl2
CaCO3+2NaCl═Na2CO3+CaCl2
;(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是
b
b
;a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(6)联碱法中,每当通入NH3 44.8L(已折合成标准状况下)时可以得到纯碱100.0g则NH3的利用率为
94.3%
94.3%
.相比于氨碱法,指出联碱法的一项优点不产生无用的CaCl2或提高了食盐的转化率等
不产生无用的CaCl2或提高了食盐的转化率等
?某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦….
请根据上面叙述,回答:
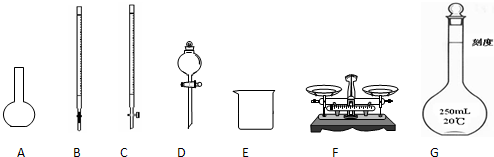
(1)图所示仪器中,本实验步骤①②③中必须用到的仪器是E和
(2)步骤②中加入盐酸的作用
(3)写出步骤④中发生反应的离子方程式
(4)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成
(5)第⑥步的操作中,将沉淀物转移到
(6)本实验需要称量的最少次数是
×100%
×100%.(列出算式,不需化简)
(7)已知Cl2与热的NaOH溶液可发生如下反应:
3Cl2+6NaOH
5NaCl+NaClO3+3H2O
则Fe3+、KClO3、Cl2三种物质其氧化性由强到弱的顺序是
查看习题详情和答案>>
①称取a g样品,置于烧杯中;
②加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦….
请根据上面叙述,回答:

(1)图所示仪器中,本实验步骤①②③中必须用到的仪器是E和
CFG
CFG
(填字母).(2)步骤②中加入盐酸的作用
增强溶液酸性,抑止Fe2+Fe3+水解;
增强溶液酸性,抑止Fe2+Fe3+水解;
.(3)写出步骤④中发生反应的离子方程式
Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+
Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+
.(4)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
6
6
Fe2++1
1
ClO3-+6
6
═6
6
Fe3++1
1
Cl-+3
3
H2O从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成
无影响
无影响
(填偏大、偏小或不影响),等物质的量的NaClO3与Cl2的氧化效率之比为3:1
3:1
(5)第⑥步的操作中,将沉淀物转移到
坩埚
坩埚
(填仪器名称)中加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是继续加热一段时间后,把坩埚放置于干燥器中冷却,再称量,至最后两次称得的质量差不超过0.1g为止
继续加热一段时间后,把坩埚放置于干燥器中冷却,再称量,至最后两次称得的质量差不超过0.1g为止
.(6)本实验需要称量的最少次数是
5
5
次,若容器质量是W1g,最终容器和固体的总质量是W2g,则样品中铁元素的质量分数为| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
(7)已知Cl2与热的NaOH溶液可发生如下反应:
3Cl2+6NaOH
| ||
则Fe3+、KClO3、Cl2三种物质其氧化性由强到弱的顺序是
KClO3>Cl2>Fe3+
KClO3>Cl2>Fe3+
. 某化学研究性小组在用铝与稀硫酸的反应制氢气的实验时发现,如果把在空气中放置一段时间的5.0g铝片放入圆底烧瓶中,然后通过分液漏斗加入500mL 0.5mol/L硫酸溶液,充分反应后,该小组同学根据记录数据得到了产生氢气的速率与反应时间的关系图象(如图所示),请你帮助该小组同学回答下列问题:
某化学研究性小组在用铝与稀硫酸的反应制氢气的实验时发现,如果把在空气中放置一段时间的5.0g铝片放入圆底烧瓶中,然后通过分液漏斗加入500mL 0.5mol/L硫酸溶液,充分反应后,该小组同学根据记录数据得到了产生氢气的速率与反应时间的关系图象(如图所示),请你帮助该小组同学回答下列问题:(1)曲线OA段不产生氢气的原因是
硫酸首先与铝片表面的Al2O3反应
硫酸首先与铝片表面的Al2O3反应
,有关的离子反应方程式为Al2O3+6H+=2Al3++3H2O
Al2O3+6H+=2Al3++3H2O
;(2)曲线BC段产生氢气的速率突然加快的主要原因是
由于反应放出的热量使溶液温度升高而使反应速率加快了
由于反应放出的热量使溶液温度升高而使反应速率加快了
;(3)点C以后产生氢气的速率逐渐减小的主要原因是
随着反应的进行,硫酸溶液的浓度逐渐下降
随着反应的进行,硫酸溶液的浓度逐渐下降
;(4)从理论上分析该小组同学能收集到氢气的体积为(标准状况下)
5.6L
5.6L
.某化学兴趣小组测定某Fe2(SO4)3样品(只含少量Fec12杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取ag样品,置于烧杯中;
②加入50mL 1.0mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤 ②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…
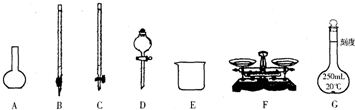
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和 (填字母).
(2)步骤②中:配制50mL,1.0mol/L稀H2SO4需要98%(密度1.84g/cm3)的浓H2SO4体积为 mL,量取该体积的浓H2SO4用到量筒规格是 .
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
Fe2++ ClO2+ ═ Fe3++ Cl-+ H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成 (填偏大、偏小或不影响),等物质的量的ClO2与Cl2的氧化效率之比为 .
(4)第⑥步的操作中,将沉淀物转移到 (填仪器名称)中加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是 .
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会 (填偏大、偏小或不影响);若容器质量是W1g,最终容器和固体的总质量是W2g,则样品中铁元素的质量分数为 ,(列出算式,不需化简)
查看习题详情和答案>>
①称取ag样品,置于烧杯中;
②加入50mL 1.0mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤 ②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…

请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和
(2)步骤②中:配制50mL,1.0mol/L稀H2SO4需要98%(密度1.84g/cm3)的浓H2SO4体积为
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成
(4)第⑥步的操作中,将沉淀物转移到
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会
某些资料认为:NO、NO2不能与Na2O2反应.某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
(1)小组甲同学设计实验如下(图1):①试管A中反应的化学方程式是 .
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将余烬木条迅速伸进试管内,看见木条复燃.甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是 .
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;
余烬木条未复燃.得出结论:假设Ⅰ正确.NO2和Na2O2反应的方程式是 .
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化.查阅资料:
①2NO+Na2O2═2NaNO2
②6NaNO2+3H2SO4═3Na2SO4+2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
丙同学用如图2所示装置(部分夹持装置略)探究NO与Na2O2的反应.
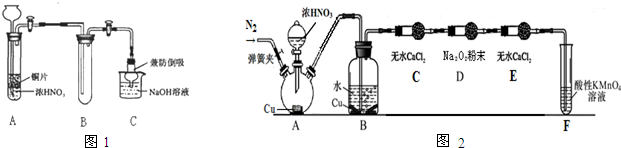
①B中观察到的主要现象是 ,F装置的作用是 .
②在反应前,打开弹簧夹,通入一段时间N2,目的是 .
③充分反应后,检验D装置中发生反应的实验是 .
查看习题详情和答案>>
假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
(1)小组甲同学设计实验如下(图1):①试管A中反应的化学方程式是
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将余烬木条迅速伸进试管内,看见木条复燃.甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;
余烬木条未复燃.得出结论:假设Ⅰ正确.NO2和Na2O2反应的方程式是
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化.查阅资料:
①2NO+Na2O2═2NaNO2
②6NaNO2+3H2SO4═3Na2SO4+2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
丙同学用如图2所示装置(部分夹持装置略)探究NO与Na2O2的反应.

①B中观察到的主要现象是
②在反应前,打开弹簧夹,通入一段时间N2,目的是
③充分反应后,检验D装置中发生反应的实验是