摘要:4.有CH3COOH与CH3COONa等物质的量混合配成的溶液.pH为4.7.下列说法中错 误的是 A. CH3COOH 的电离作用大于CH3COONa的水解作用 B. CH3COONa 的水解作用大于CH3COOH的电离作用 C. CH3COOH 的存在抑制了CH3COONa的水解 D. CH3COONa 的存在抑制了CH3COOH的电离
网址:http://m.1010jiajiao.com/timu3_id_362736[举报]
如图1所示三个烧瓶中分别装入含酚酞的0.01mol?L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.

(1)含酚酞的0.01mol?L-1 CH3COONa溶液显浅红色的原因为:
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01mol?L-1 CH3COONa溶液中加入少量浓盐酸,则CH3COO-水解平衡移动的方向为_
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO- )-c(Na+)=
(5)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图2,则HX的酸性
查看习题详情和答案>>

(1)含酚酞的0.01mol?L-1 CH3COONa溶液显浅红色的原因为:
CH3COO-+H2O?CH3COOH+OH-
CH3COO-+H2O?CH3COOH+OH-
(用离子方程式表示).(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是
B、D
B、D
.A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01mol?L-1 CH3COONa溶液中加入少量浓盐酸,则CH3COO-水解平衡移动的方向为_
右
右
_; 加入NaOH固体,则CH3COO-水解平衡移动的方向为左
左
(填“左”、“右”或“不移动”)(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO- )-c(Na+)=
9.9×10-7mol/L
9.9×10-7mol/L
.(填准确数值)(5)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图2,则HX的酸性
>
>
(填“>”、“=”或“<”)醋酸的酸性;稀释后,HX溶液中水电离出来的c(H+)>
>
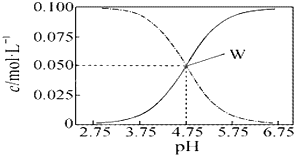
醋酸溶液水电离出来c(H+)(填“>”、“=”或“<”). (2012?江苏)25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol?L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )
(2012?江苏)25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol?L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )