摘要:从月桂叶油中分离出两种异构体化合物Z和W,它们都具有C10H12O的化学式它们都不溶于水.稀酸及稀碱.对稀KMnO4和Br2/CCl4溶液都发生反应.经剧烈气化都生成茴香酸(m-CH3OC6H4COOH,m-间位).催化氢化可使Z和W转变成同一化合物(C10H14O).已知:
网址:http://m.1010jiajiao.com/timu3_id_362558[举报]
煤的气化是高效、清洁地利用煤炭的重要途径之一.
(1)在250C 101kPa时,H2与02化合生成1mol H2O(g)放出241.8kJ的热量,其热化学 方程式为
又知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+
O2(g)═CO2(g)△H=-283.0kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)?CO(g)+Hi(g)△H= kj/mol.
(2)CO可以与H2CXg)进一步发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0在恒容密闭容器中,起始时n(H20)=0.20mol,n(CO)=0.10mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是(计算结果保留一位小数).
(3)工业上从煤气化后的混合物中分离出H2,进行氨的合成,已知反应N2(g)+3H2(g)
2NH3((g) (△H<0)在等容条件下进行.改变其他反应条件,在I、II、III阶段体 系中各物质浓度随时间变化的曲线如图所示:
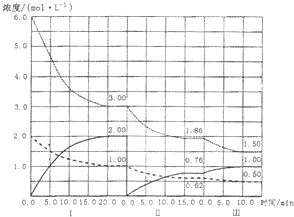
①N2的平均反应速率v1(N2)、vII(N2)、vIII(N2)从大到小排列次序为 ;
②由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是
③比较第II阶段反应温度(T2)和第III阶段反应速度(T3)的高低:T2 T3填“>、=、<”判断的理由是 .
查看习题详情和答案>>
(1)在250C 101kPa时,H2与02化合生成1mol H2O(g)放出241.8kJ的热量,其热化学 方程式为
又知:①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+
| 1 |
| 2 |
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)?CO(g)+Hi(g)△H=
(2)CO可以与H2CXg)进一步发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0在恒容密闭容器中,起始时n(H20)=0.20mol,n(CO)=0.10mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是(计算结果保留一位小数).
(3)工业上从煤气化后的混合物中分离出H2,进行氨的合成,已知反应N2(g)+3H2(g)
| 催化剂 |

①N2的平均反应速率v1(N2)、vII(N2)、vIII(N2)从大到小排列次序为
②由第一次平衡到第二次平衡,平衡移动的方向是
③比较第II阶段反应温度(T2)和第III阶段反应速度(T3)的高低:T2
某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)步骤Ⅱ产生的气体是 .
(2)步骤Ⅲ中,“从反应后的混合物中分离出黑色沉淀”的操作是 .
(3)该同学假设黑色沉淀是CuO.检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+.
①将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是 .
(4)再次假设,黑色沉淀是铜的硫化物.实验如下:
①现象2说明黑色沉淀具有 性.
②产生红棕色气体的化学方程式是 .
③能确认黑色沉淀中含有S元素的现象是 ,相应的离子方程式是 .
④为确认黑色沉淀是“铜的硫化物”,还需进行的实验是 .
(5)以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是 .
查看习题详情和答案>>
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
(1)步骤Ⅱ产生的气体是
(2)步骤Ⅲ中,“从反应后的混合物中分离出黑色沉淀”的操作是
(3)该同学假设黑色沉淀是CuO.检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+.
①将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀.
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀.
由该检验过程所得结论是
(4)再次假设,黑色沉淀是铜的硫化物.实验如下:
| 实验装置 | 现象 |
 |
1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
②产生红棕色气体的化学方程式是
③能确认黑色沉淀中含有S元素的现象是
④为确认黑色沉淀是“铜的硫化物”,还需进行的实验是
(5)以上实验说明,黑色沉淀中存在铜的硫化物.进一步实验后证明黑色沉淀是CuS与Cu2S的混合物.将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是
海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
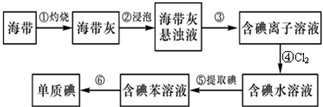
(1)步骤①灼烧海带时,盛装海带的实验仪器是 .
A.烧杯 B.坩埚 C.试管 D.烧瓶 E.蒸发皿
(2)步骤③的实验操作名称是 ; 步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 .
(3)步骤④的目的是: .
(4)步骤⑤中,选择用苯来提取碘的理由有两条.酒精只符合其中的一条,不能选择用酒精来提取碘的理由是: .
(5)请设计一个简单实验,检验提取碘后的水溶液中是否还含有单质碘 .
查看习题详情和答案>>

(1)步骤①灼烧海带时,盛装海带的实验仪器是
A.烧杯 B.坩埚 C.试管 D.烧瓶 E.蒸发皿
(2)步骤③的实验操作名称是
(3)步骤④的目的是:
(4)步骤⑤中,选择用苯来提取碘的理由有两条.酒精只符合其中的一条,不能选择用酒精来提取碘的理由是:
(5)请设计一个简单实验,检验提取碘后的水溶液中是否还含有单质碘
海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是
(3)步骤④反应的离子方程式是
(4)步骤⑤中,某学生选择用苯来提取碘的理由是
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
查看习题详情和答案>>

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是
BDE
BDE
(从下列仪器中选出所需的仪器,用标号字母填写在空白处).A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是
过滤
过滤
;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是蒸馏
蒸馏
.(3)步骤④反应的离子方程式是
2I-+MnO2+4H+=Mn2++I2+2H2O
2I-+MnO2+4H+=Mn2++I2+2H2O
.(4)步骤⑤中,某学生选择用苯来提取碘的理由是
苯与水互不相溶;碘在苯中的溶解度比在水中大
苯与水互不相溶;碘在苯中的溶解度比在水中大
.(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
取少量提取碘后的水溶液于试管中,加入几滴淀粉试液;观察是否出现蓝色(如果变蓝,说明还有单质碘)
取少量提取碘后的水溶液于试管中,加入几滴淀粉试液;观察是否出现蓝色(如果变蓝,说明还有单质碘)
.