摘要:15.分别电解100mL 0.1mol·L-1的硝酸银和硫酸铜溶液.若还原的硝酸银和硫酸铜的物质的量之比为2:1.则下列叙述正确的是 ( ) A.在两个阴极上得到的银和铜的物质的量之比为2:1 B.在两个阳极上得到的产物的物质的理不相等 C.通过两溶液的电量不相等 D.电解过程中.两溶液中氢离子的物质的量都增加 16.用纯净的CaCO3与100mL稀盐酸反应制取CO2.实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).下列分析正确的是 ( ) A.OE段表示的平均速率最快 B.EF段.用盐酸表示该反应的平均反应速率 为0.4mol/ C.OE.EF.FG三段中.该反应用二氧化碳 表示的平均反应速率之比为2:6:7 D.G点表示收集的CO2的量最多
网址:http://m.1010jiajiao.com/timu3_id_362477[举报]
 如图为细菌冶铜和火法冶铜的主要流程.
如图为细菌冶铜和火法冶铜的主要流程.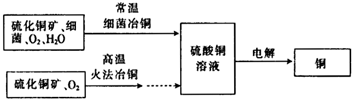
(1)①写出用惰性电极电解硫酸铜溶液的化学方程式:
②若电解一定时间后,外加0.1mol的氢氧化铜可使电解液恢复到电解前的浓度,电路中转移电子物质的量
(2)细菌冶金又称微生物浸矿,是近代湿法冶金工业上的一种新工艺.细菌冶铜与火法冶铜相比,优点为
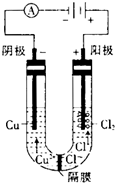
(3)用惰性电极分别电解浓的氯化铜溶液和硫酸铜溶液.电解浓的氯化铜溶液时发现阴极有金属铜生成,同时阴极附近会出现棕褐色溶液.而电解硫酸铜溶液时,没有棕褐色溶液生成.下面是关于棕褐色溶液成分的探究:
①有同学认为,阴极附近出现的棕褐色溶液是氯气反应的结果,你认为他的猜测是否正确?
资料1:
一般具有混合价态(指化合物中同一元素存在两种不同的化合价,如Fe3O4中的Fe元索)的物质的颜色比单一价态的物质的颜色要深.
资料2:
CuCl微溶于水,能溶于浓盐酸.
②猜想:棕褐色溶液中可能含有的离子是
③验证猜想:完成实验方案(配制棕褐色溶液).取少量
④已知电解前,U形管中加入了100mL 0.5mol?L-1 CuCl2溶液,电解结朿时电路中一共转移了0.03mol电子,且阴极生成0.64g铜,则形成的低价阳离子的物质的量为
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料做惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-离子.
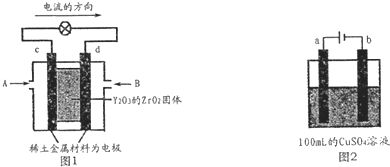
(1)c电极的名称为
(2)如图2所示电解100mL 0.5mol?L-1 CuSO4溶液,a电极上的电极反应式为
a. CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3.
查看习题详情和答案>>

(1)c电极的名称为
正极
正极
,d电极上的电极反应式为CH4+4O2-═CO2+2H2O+8e-
CH4+4O2-═CO2+2H2O+8e-
.(2)如图2所示电解100mL 0.5mol?L-1 CuSO4溶液,a电极上的电极反应式为
4OH-═2H2O+O2↑+4e-
4OH-═2H2O+O2↑+4e-
.若a电极产生56mL(标准状况)气体,则所得溶液的pH=1
1
(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入ac
ac
(填序号).a. CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3.
(2011?昌平区二模)A、B、C、D四种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的原子核外电子总数是电子层数的4倍,D是所在周期原子半径最大的元素.又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体.请回答下列问题:
(1)D在元素周期表中的位置是
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为
 .
.
(3)D与C形成的化合物可与Y反应生成单质Z,该反应的化学方程式为
(4)写出实验室制备BA3的化学方程式
(5)已知B2A4可燃烧生成B的单质和Y,以B2A4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池负极反应是
查看习题详情和答案>>
(1)D在元素周期表中的位置是
第三周期第ⅠA族
第三周期第ⅠA族
.(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为


(3)D与C形成的化合物可与Y反应生成单质Z,该反应的化学方程式为
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
;若有1mol电子转移,生成Z的物质的量为0.5
0.5
mol.(4)写出实验室制备BA3的化学方程式
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.将BA3通入溴水中可发生反应,生成一种单质和一种盐,写出该反应的离子方程式
| ||
8NH3+3Br2=N2+6NH4++6Br-
8NH3+3Br2=N2+6NH4++6Br-
.(5)已知B2A4可燃烧生成B的单质和Y,以B2A4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池负极反应是
N2H4+4OH--4e-═N2+4H2O
N2H4+4OH--4e-═N2+4H2O
.以石墨为电极,用该电池电解100mL饱和食盐水,一段时间后,在两极共收集到224mL气体(标准状况下),此时溶液的pH是(忽略溶液体积的变化)13
13
.四种短周期元素A、B、C、D的性质或结构信息如下.
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题.
(1)①C元素在周期表中的位置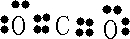
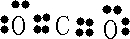 .
.
②A元素的单质与物质甲发生反应的离子方程式
③以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,写出电池的电极反应式.负极
(2)A所在周期中,E元素的单质还原性最强,A、E单质反应得到的化合物M是一种重要的化工原料,如图是电解100ml饱和M溶液的装置,X、Y都是惰性电极,实验开始时,同时在两边各滴入几滴酚酞试液,则

①电解池中Y极上的电极反应式
②电解一段时间后,若阴极收集到112ml标准状况下的气体,此时电解液的PH为
查看习题详情和答案>>
信息①原子半径大小:A>B>C>D
信息②四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题.
(1)①C元素在周期表中的位置
第二周期ⅥA族
第二周期ⅥA族
,请写出BC2分子的电子式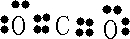
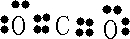
②A元素的单质与物质甲发生反应的离子方程式
Cl2+H2O H++Cl-+HClO
H++Cl-+HClO
 H++Cl-+HClO
H++Cl-+HClOCl2+H2O H++Cl-+HClO
H++Cl-+HClO
. H++Cl-+HClO
H++Cl-+HClO③以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,写出电池的电极反应式.负极
CH4-8e-+10OH-=CO32-+7H2O
CH4-8e-+10OH-=CO32-+7H2O
;正极2O2+8e-+4H2O=8OH-
2O2+8e-+4H2O=8OH-
(2)A所在周期中,E元素的单质还原性最强,A、E单质反应得到的化合物M是一种重要的化工原料,如图是电解100ml饱和M溶液的装置,X、Y都是惰性电极,实验开始时,同时在两边各滴入几滴酚酞试液,则

①电解池中Y极上的电极反应式
2Cl-2e-=Cl2↑
2Cl-2e-=Cl2↑
.检验Y电极反应产物的方法是把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色
把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色
.②电解一段时间后,若阴极收集到112ml标准状况下的气体,此时电解液的PH为
13
13
(假设电解液的体积保持不变,常温下)(16分)四种短周期元素A、B、C、D的性质或结构信息如下。
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
请根据上述信息回答下列问题。
(1)①C元素在周期表中的位置 , 请写出BC2分子的电子式____________。
②A元素的单质与物质甲发生反应的离子方程式___________________。
③以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,写出电池的电极反应式。负极_________________;正极(2)A所在周期中, E元素的单质还原性最强,A、E单质反应得到的化合物M是一种重要的化工原料,如图是电解100ml饱和M溶液的装置,
X、Y都是惰性电极,实验开始时,同时在两边各滴入
几滴酚酞试液,则
①电解池中Y极上的电极反应式 。
检验Y电极反应产物的方法是
②电解一段时间后,若阴极收集到112ml标准状况下的气体,
此时电解液的PH为 (假设电解液的体积保持不变,常温下)
查看习题详情和答案>>