题目内容
 如图为细菌冶铜和火法冶铜的主要流程.
如图为细菌冶铜和火法冶铜的主要流程.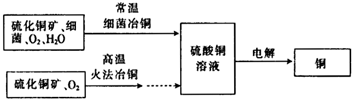
(1)①写出用惰性电极电解硫酸铜溶液的化学方程式:
②若电解一定时间后,外加0.1mol的氢氧化铜可使电解液恢复到电解前的浓度,电路中转移电子物质的量
(2)细菌冶金又称微生物浸矿,是近代湿法冶金工业上的一种新工艺.细菌冶铜与火法冶铜相比,优点为
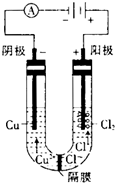
(3)用惰性电极分别电解浓的氯化铜溶液和硫酸铜溶液.电解浓的氯化铜溶液时发现阴极有金属铜生成,同时阴极附近会出现棕褐色溶液.而电解硫酸铜溶液时,没有棕褐色溶液生成.下面是关于棕褐色溶液成分的探究:
①有同学认为,阴极附近出现的棕褐色溶液是氯气反应的结果,你认为他的猜测是否正确?
资料1:
一般具有混合价态(指化合物中同一元素存在两种不同的化合价,如Fe3O4中的Fe元索)的物质的颜色比单一价态的物质的颜色要深.
资料2:
CuCl微溶于水,能溶于浓盐酸.
②猜想:棕褐色溶液中可能含有的离子是
③验证猜想:完成实验方案(配制棕褐色溶液).取少量
④已知电解前,U形管中加入了100mL 0.5mol?L-1 CuCl2溶液,电解结朿时电路中一共转移了0.03mol电子,且阴极生成0.64g铜,则形成的低价阳离子的物质的量为
分析:(1)①惰性电极电解一定量的硫酸铜溶液,阴极,发生Cu2++2e-═Cu,阳极,溶液中的氢氧根离子放电,4OH--4e-═H2O+O2↑;
②电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入0.1mol的氢氧化铜可使电解液恢复到电解前的浓度,氢氧化铜和硫酸反应生成硫酸铜、水,依据电解硫酸铜溶液的反应过程,分析加入氢氧化铁恢复溶液浓度是电解硫酸铜溶液,电解水的过程分析判断;
(2)从能源及操作等方面来考虑细菌冶铜的优点;
(3)用惰性电极电解氯化铜溶液,第一阶段:阳极发生氧化反应:2Cl--2e-=Cl2↑,阴极发生还原反应:Cu2++2e-=Cu,第二阶段:2H2O
2H2↑+O2↑;电解硫酸铜溶液时第一阶段:2CuSO4+2H2O
2Cu↓+O2↑+2H2SO4,第二阶段:2H2O
2H2↑+O2↑,
①电解浓的氯化铜溶液,第二阶段电解水,阴极还会产生氢气,阴极不可能生成氯气;
②根据混合价态的物质的颜色比单一价态的物质的颜色深、CuCl微溶于水,能溶于浓盐酸分析解答;
③根据CuCl、CuCl2的性质分析解答;
④利用电子守恒法解答,生成0.64g铜转移0.02mol电子,还有0.01mol电子为+2价铜离子得电子生成+1价的铜离子,据此分析解答;
②电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入0.1mol的氢氧化铜可使电解液恢复到电解前的浓度,氢氧化铜和硫酸反应生成硫酸铜、水,依据电解硫酸铜溶液的反应过程,分析加入氢氧化铁恢复溶液浓度是电解硫酸铜溶液,电解水的过程分析判断;
(2)从能源及操作等方面来考虑细菌冶铜的优点;
(3)用惰性电极电解氯化铜溶液,第一阶段:阳极发生氧化反应:2Cl--2e-=Cl2↑,阴极发生还原反应:Cu2++2e-=Cu,第二阶段:2H2O
| ||
| ||
| ||
①电解浓的氯化铜溶液,第二阶段电解水,阴极还会产生氢气,阴极不可能生成氯气;
②根据混合价态的物质的颜色比单一价态的物质的颜色深、CuCl微溶于水,能溶于浓盐酸分析解答;
③根据CuCl、CuCl2的性质分析解答;
④利用电子守恒法解答,生成0.64g铜转移0.02mol电子,还有0.01mol电子为+2价铜离子得电子生成+1价的铜离子,据此分析解答;
解答:解:(1)①用惰性电极电解硫酸铜溶液,电解过程中,始终无氢气产生,则阴极发生Cu2++2e-═Cu,阳极氢氧根离子放电,4OH--4e-═H2O+O2↑,总反应为:2CuSO4+2H2O
2Cu↓+O2↑+2H2SO4,
故答案为:2CuSO4+2H2O
2Cu↓+O2↑+2H2SO4;
②用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度,说明原来电解是开始电解硫酸铜溶液2CuSO4+2H2O
2Cu↓+O2↑+2H2SO4,随后电解水2H2O
2H2↑+O2↑,根据加入0.1molCu(OH)2后恢复到电解前的浓度,Cu(OH)2+H2SO4=CuSO4+2H2O根据原子守恒,将Cu(OH)2化学式改变为CuO?H2O,所以加入0.1molCu(OH)2就相当于加入0.1molCuO和0.1mol水,溶液中增加0.1mol氧化铜、0.1mol水,说明电解的硫酸铜为0.1mol,电解的水0.1mol,所以电解过程中转移电子为:反应Cu2++2e-=Cu,转移0.2mol电子,电解0.1mol水,2H2O
2H2↑+O2↑,转移电子物质的量为0.2mol,所以共转移电子0.4mol,
故答案为:0.4mol;
(2)湿法炼铜需在溶液中进行,相比湿法炼铜,细菌冶铜,在常温下用生物冶铜,节约能源、环保、设备简单、操作方便;工艺条件易控制、投资少、成本低,适宜处理炉渣,
故答案为:节约能源、环保、设备简单、操作方便;工艺条件易控制、投资少、成本低;适宜处理炉渣;
(3)用惰性电极电解氯化铜溶液,第一阶段:阳极发生氧化反应:2Cl--2e-=Cl2↑,阴极发生还原反应:Cu2++2e-=Cu,第二阶段:2H2O
2H2↑+O2↑;电解硫酸铜溶液时第一阶段:2CuSO4+2H2O
2Cu↓+O2↑+2H2SO4,第二阶段:2H2O
2H2↑+O2↑,
①用惰性电极电解氯化铜溶液,电解过程中阳离子向阴极移动,所以阴极:第一阶段:Cu2++2e-=Cu,第二阶段:2H++2e-=H2↑,阴极不可能生成氯气,所以阴极附近会出现棕褐色溶液,并不是氯气反应的结果,
故答案为:不正确;阴极还会产生氢气;
②根据题干信息,混合价态的物质的颜色比单一价态的物质的颜色深,铜有Cu2+、Cu+的离子,所以棕褐色溶液中可能含有的离子是Cu2+、Cu+,溶液中还可能存在阴离子Cl-,
故答案为:Cu2+、Cu+、Cl-;
③为了验证溶液中是否存在Cu2+、Cu+,可通过对照试验进行验证,取少量氯化亚铜,固体于试管中,加入浓盐酸使其溶解,再加入氯化铜溶液,观察现象,
故答案为:氯化亚铜;浓盐酸;氯化铜;
④100mL 0.5mol?L-1 CuCl2溶液中含0.05molCuCl2,Cu2++2e-=Cu,生成0.64g铜转移0.02mol电子,电解结朿时电路中一共转移了0.03mol电子,根据题干信息,混合价态的物质的颜色比单一价态的物质的颜色深,所以还有0.01mol电子为+2价铜离子得电子生成+1价的铜离子,Cu2++e-=Cu+,则形成的低价阳离子的物质的量为0.01mol,
故答案为:0.01;
| ||
故答案为:2CuSO4+2H2O
| ||
②用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度,说明原来电解是开始电解硫酸铜溶液2CuSO4+2H2O
| ||
| ||
| ||
故答案为:0.4mol;
(2)湿法炼铜需在溶液中进行,相比湿法炼铜,细菌冶铜,在常温下用生物冶铜,节约能源、环保、设备简单、操作方便;工艺条件易控制、投资少、成本低,适宜处理炉渣,
故答案为:节约能源、环保、设备简单、操作方便;工艺条件易控制、投资少、成本低;适宜处理炉渣;
(3)用惰性电极电解氯化铜溶液,第一阶段:阳极发生氧化反应:2Cl--2e-=Cl2↑,阴极发生还原反应:Cu2++2e-=Cu,第二阶段:2H2O
| ||
| ||
| ||
①用惰性电极电解氯化铜溶液,电解过程中阳离子向阴极移动,所以阴极:第一阶段:Cu2++2e-=Cu,第二阶段:2H++2e-=H2↑,阴极不可能生成氯气,所以阴极附近会出现棕褐色溶液,并不是氯气反应的结果,
故答案为:不正确;阴极还会产生氢气;
②根据题干信息,混合价态的物质的颜色比单一价态的物质的颜色深,铜有Cu2+、Cu+的离子,所以棕褐色溶液中可能含有的离子是Cu2+、Cu+,溶液中还可能存在阴离子Cl-,
故答案为:Cu2+、Cu+、Cl-;
③为了验证溶液中是否存在Cu2+、Cu+,可通过对照试验进行验证,取少量氯化亚铜,固体于试管中,加入浓盐酸使其溶解,再加入氯化铜溶液,观察现象,
故答案为:氯化亚铜;浓盐酸;氯化铜;
④100mL 0.5mol?L-1 CuCl2溶液中含0.05molCuCl2,Cu2++2e-=Cu,生成0.64g铜转移0.02mol电子,电解结朿时电路中一共转移了0.03mol电子,根据题干信息,混合价态的物质的颜色比单一价态的物质的颜色深,所以还有0.01mol电子为+2价铜离子得电子生成+1价的铜离子,Cu2++e-=Cu+,则形成的低价阳离子的物质的量为0.01mol,
故答案为:0.01;
点评:本题是实验探究题,考查电解池以及相关元素化合物知识,为高频考点,侧重于学生的分析能力的考查,注意把握氧化还原知识以及电子守恒的计算,题目难度中等.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目