摘要:28.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑,CO2+NaOH=NaHCO3 (2)20g (3)在氢氧化钠溶液中通人过量二氧化碳.过滤 (4)Na2CO3 0.125mol
网址:http://m.1010jiajiao.com/timu3_id_362421[举报]
原子序数从小到大排列的四种短周期元素W、X、Y、Z,四种元素的原子最外层电子数之和等于13;W是原子半径最小的元素;由X、Y元素可组成非极性分子A,A在常温下为气体; 可以通过电解熔融Z的氯化物提取单质Z;B为浅黄色固体物质,且A与B反应可生成Y2气体.
(1)元素W是(填元素名称) ;写出B的电子式
(2)Z在A中燃烧生成黑色固体颗粒和大量白烟,写出发生的化学方程式: 该反应属于 (填写序号)
a 置换反应 b 化合反应 c 分解反应 d 复分解反应 e 氧化还原反应
(3)C是由X、Y、Z三种元素组成的盐,C能与盐酸反应生成A,则C的化学式是 ;试从结构的角度解释该物质比CaCO3更易分解的原因
(4)D是由W、X、Y 三种元素按原子个数比为1:1:2组成的一种弱酸,D在常温下为固体.D能使酸性高锰酸钾酸性溶液褪色,说明D具有 性,写出化学反应方程式 ;写出D溶液中的离子的电荷守恒式 .
查看习题详情和答案>>
(1)元素W是(填元素名称)
(2)Z在A中燃烧生成黑色固体颗粒和大量白烟,写出发生的化学方程式:
a 置换反应 b 化合反应 c 分解反应 d 复分解反应 e 氧化还原反应
(3)C是由X、Y、Z三种元素组成的盐,C能与盐酸反应生成A,则C的化学式是
(4)D是由W、X、Y 三种元素按原子个数比为1:1:2组成的一种弱酸,D在常温下为固体.D能使酸性高锰酸钾酸性溶液褪色,说明D具有
(2013?哈尔滨模拟)如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视,所以“低碳经济”正成为科学家研究的主要课题.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的离子方程式:
+
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中.进行反应
CO+H2O?CO2(g)+H2(g)得到如下两组数据:
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为
②该反应为
(3)以二甲醚(CH3OCH3)、空气、氢氧化钾为原料,铂为电极可构成燃料电池,其工作原理 与甲烷燃料电池的原理相似.请写出该电池负极上的电极反应式:
(4)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ?mol-1、-283.0kJ?mol -1和-726.5kJ?mol-1.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9(25℃).现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为2×10-4mol?L-1,则生成沉淀所需原CaCl2溶液的最小浓度为
查看习题详情和答案>>
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的离子方程式:
5
5
C+4
4
MnO- 4 |
12
12
H+═5
5
CO2↑+4
4
Mn2++6
6
H2O(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中.进行反应
CO+H2O?CO2(g)+H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
0.13mol/(L?min)
0.13mol/(L?min)
(精确到0.01,下同)②该反应为
放
放
(填“吸”或“放”)热反应,实验2条件下平衡常数K=0.17
0.17
.(3)以二甲醚(CH3OCH3)、空气、氢氧化钾为原料,铂为电极可构成燃料电池,其工作原理 与甲烷燃料电池的原理相似.请写出该电池负极上的电极反应式:
CH3OCH3+160H--12e-═2CO32-+11H2O
CH3OCH3+160H--12e-═2CO32-+11H2O
.(4)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ?mol-1、-283.0kJ?mol -1和-726.5kJ?mol-1.请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:
CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1
CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1
.(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9(25℃).现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为2×10-4mol?L-1,则生成沉淀所需原CaCl2溶液的最小浓度为
5.6×10-5mol/L
5.6×10-5mol/L
.某含有Na2O杂质的Na2O2试样,请设计实验测定该样品的纯度.可供选择的装置:

可供选择的药品:CaCO3固体,6mol/L盐酸,蒸馏水
请回答下列问题:
(1)用上述装置可以组装一套最简单的测定过氧化钠样品纯度的实验装置,设计选择的仪器组合是
A.①④⑤B.①②④⑤C.⑤⑥⑦D.①③⑤⑦
(2)实验选择的药品是
(3)写出实验中Na2O2和Na2O分别发生反应的离子方程式:
(4)用上述实验后所得溶液配制成浓度为1.0mol/L的溶液.
①向400ml该溶液中通入0.3mol CO2,则所得溶液中HCO3-和CO32-的物质的量浓度之比约为
A.1:3 B.1:2 C.2:1 D.3:1
②将上述溶液蒸发结晶得到Na2CO3和NaHCO3固体混合物,能测定混合物中Na2CO3质量分数的是
A.取a克混合物充分加热,在干燥器中冷却至室温,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
(5)井下采煤个人用的自救器(类似呼吸面具)中盛放的也是过氧化钠,写出体现自救器自救功能的化学反应方程式:
查看习题详情和答案>>

可供选择的药品:CaCO3固体,6mol/L盐酸,蒸馏水
请回答下列问题:
(1)用上述装置可以组装一套最简单的测定过氧化钠样品纯度的实验装置,设计选择的仪器组合是
A
A
(填字母).A.①④⑤B.①②④⑤C.⑤⑥⑦D.①③⑤⑦
(2)实验选择的药品是
质量数
质量数
,所选用装置的连接顺序应是(填各接口的字母,连接胶管省略)(G)接(A)(B)接(F)
(G)接(A)(B)接(F)
(填字母)(3)写出实验中Na2O2和Na2O分别发生反应的离子方程式:
2Na2O2+2H2O═4Na++4OH-+O2↑
2Na2O2+2H2O═4Na++4OH-+O2↑
;2Na2O+2H2O═4Na++4OH-
2Na2O+2H2O═4Na++4OH-
.(4)用上述实验后所得溶液配制成浓度为1.0mol/L的溶液.
①向400ml该溶液中通入0.3mol CO2,则所得溶液中HCO3-和CO32-的物质的量浓度之比约为
C
C
A.1:3 B.1:2 C.2:1 D.3:1
②将上述溶液蒸发结晶得到Na2CO3和NaHCO3固体混合物,能测定混合物中Na2CO3质量分数的是
ABD
ABD
.A.取a克混合物充分加热,在干燥器中冷却至室温,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
(5)井下采煤个人用的自救器(类似呼吸面具)中盛放的也是过氧化钠,写出体现自救器自救功能的化学反应方程式:
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2CO2═2Na2CO3+O2
.(2013?绍兴一模)绿色化制氢技术是现代能源工业的方向,以CaO为吸收体,将生物质(以C计)与水蒸气反应制取H2.反应装置由气化炉和燃烧炉两个反应器组成,相关反应如下表所示:
请回答下列问题:
(1)气化炉中总反应:C(s)+2H2O(g)+CaO(s)=CaCO3(s)+2H2(g)△H=
(2)燃烧炉中反应⑤所需的能量由反应④提供.如果再生1mol CaO,至少需通入纯氧
(3)当只改变温度或压力时,反应⑤有如图所示的变化:
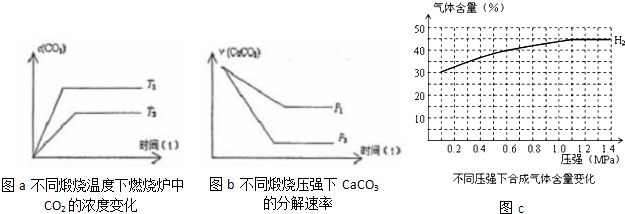
图a推知T1
图b推知P1
(4)在一定温度、不同压力时,气化炉中H2的变化量约等于CO的变化量(即△n(H2)=△n(CO)),当起始c(H2):c(CO)=3:2时,请根据n(H2)变化,补充完整图C中n(CO)图示变化.
(5)一定条件下,气化炉中的各反应达到平衡状态,采取以下措施可以提高H2产量的是
A.反应②中使用合适的催化剂 B.不断移走CaCO3,并升高气化炉内的温度
C.适当增加水蒸气的通入量 D.增加CaO的量,提高CO2的吸收率
(6)写出一条这种制H2技术的优点
查看习题详情和答案>>
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: ①C(s)+H2O(g)=CO(g)+H2(g) △H=+131.6kJ?mol-1 ②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ?mol-1 ③CaO(s)+CO2(g)=CaCO3(s) △H=-178.3kJ?mol-1 |
通入纯氧,主要化学反应: ④C(s)+O2(g)=CO2(g) △H=-393.8kJ?mol-1 ⑤CaCO3(s)=CaO(s)+CO2(g) K |
(1)气化炉中总反应:C(s)+2H2O(g)+CaO(s)=CaCO3(s)+2H2(g)△H=
-87.9
-87.9
kJ?mol-1(2)燃烧炉中反应⑤所需的能量由反应④提供.如果再生1mol CaO,至少需通入纯氧
0.45
0.45
mol.(3)当只改变温度或压力时,反应⑤有如图所示的变化:

图a推知T1
>
>
T2(填“>”、“<”、“=”),若温度升高,平衡常数K值增大
增大
(填“增大”、“减小”、“不变”)图b推知P1
<
<
P2(填“>”、“<”、“=”),压强增大,CaCO3的分解率减小
减小
(填“增大”、“减小”、“不变”)(4)在一定温度、不同压力时,气化炉中H2的变化量约等于CO的变化量(即△n(H2)=△n(CO)),当起始c(H2):c(CO)=3:2时,请根据n(H2)变化,补充完整图C中n(CO)图示变化.
(5)一定条件下,气化炉中的各反应达到平衡状态,采取以下措施可以提高H2产量的是
BC
BC
(用相关编号填写)A.反应②中使用合适的催化剂 B.不断移走CaCO3,并升高气化炉内的温度
C.适当增加水蒸气的通入量 D.增加CaO的量,提高CO2的吸收率
(6)写出一条这种制H2技术的优点
实现了吸收剂CaO的循环,降低了能耗;实现了能量自给,符合节能减排等
实现了吸收剂CaO的循环,降低了能耗;实现了能量自给,符合节能减排等
.