摘要:漂白粉: 制取:Cl2.消石灰 2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O 原因:比次氯酸稳定.易保存 使用:Ca(ClO)2+CO2+H2O CaCO3↓+HClO [同步达纲练习]
网址:http://m.1010jiajiao.com/timu3_id_362162[举报]
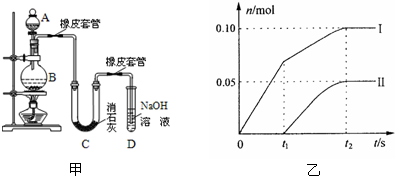
某学生设计如图甲实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
(1)A仪器的名称是
(2)漂白粉将在U型管中产生,其化学反应方程式是
(3)有同学建议在两个橡皮套管内的玻璃管口应尽量紧靠,原因是
(4)此实验结果所得Ca(ClO)2产率太低.经分析并查阅资料发现主要原因是在U型管中存在两个副反应:1度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
a、图中曲线I表示
b、所取石灰乳中含有Ca(OH)2的物质的量为
c、另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中n(ClO-)/n(ClO3-)=
②试判断另一个副反应是(写出此反应方程式)
查看习题详情和答案>>
(1)A仪器的名称是
分液漏斗
分液漏斗
,D的作用吸收尾气
吸收尾气
.(2)漂白粉将在U型管中产生,其化学反应方程式是
2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
.(3)有同学建议在两个橡皮套管内的玻璃管口应尽量紧靠,原因是
Cl2易腐蚀橡皮塞
Cl2易腐蚀橡皮塞
(4)此实验结果所得Ca(ClO)2产率太低.经分析并查阅资料发现主要原因是在U型管中存在两个副反应:1度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
将U型管置于冷水浴中
将U型管置于冷水浴中
,有同学测出了反应后溶液中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图乙(不考虑氯气和水的反应).a、图中曲线I表示
ClO-
ClO-
离子的物质的量随反应时间变化的关系.b、所取石灰乳中含有Ca(OH)2的物质的量为
0.25
0.25
mol.c、另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中n(ClO-)/n(ClO3-)=
7:6
7:6
②试判断另一个副反应是(写出此反应方程式)
2HCl+Ca(OH)2=CaCl2+2H2O
2HCl+Ca(OH)2=CaCl2+2H2O
;为避免此副反应发生,可采取的措施是发生装置和U型管之间放饱和氯化钠溶液
发生装置和U型管之间放饱和氯化钠溶液

漂粉精是一种常用的消毒剂,工业上将氯气通入石灰乳[Ca(OH)2]制取漂粉精.
(1)写出工业上制取氯气的化学方程式:
(2)工业上将氯气通入石灰乳[Ca(OH)2]制取漂粉精,化学反应方程式为
(3)用于漂白时,在溶液里加少许稀盐酸能促进漂白,有关的化学反应方程式为
(4)漂粉精溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的某种物质,该化学反应方程式为
查看习题详情和答案>>
(1)写出工业上制取氯气的化学方程式:
2NaCl+2H2O
2NaOH+H2↑+Cl2↑或2NaCl
2Na+Cl2↑
| ||
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑或2NaCl
2Na+Cl2↑
.
| ||
| ||
(2)工业上将氯气通入石灰乳[Ca(OH)2]制取漂粉精,化学反应方程式为
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.(3)用于漂白时,在溶液里加少许稀盐酸能促进漂白,有关的化学反应方程式为
Ca(ClO)2+2HCl=CaCl2+2HClO
Ca(ClO)2+2HCl=CaCl2+2HClO
.(4)漂粉精溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的某种物质,该化学反应方程式为
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).请回答下列问题:

(1)A为实验室制氯气的发生装置,某学生用12mol?L-1的浓盐酸100mL和足量的MnO2反应制Cl2.
(2)写出制漂白粉化学方程式是
(3)此实验所得漂白粉的有效成分偏低.该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
②避免另一个副反应的发生,可将装置作何改进
查看习题详情和答案>>

(1)A为实验室制氯气的发生装置,某学生用12mol?L-1的浓盐酸100mL和足量的MnO2反应制Cl2.
(2)写出制漂白粉化学方程式是
2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O
2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O
.(3)此实验所得漂白粉的有效成分偏低.该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
将B装置冷却
将B装置冷却
.②避免另一个副反应的发生,可将装置作何改进
在A、B之间接一个饱和的NaCl溶液洗气瓶
在A、B之间接一个饱和的NaCl溶液洗气瓶
.洪灾过后,饮用水的消毒杀菌成为抑制传染性疾病大规模爆发的有效方法之一.漂白粉是常用的消毒剂.
(1)工业上将氯气通入石灰乳制取漂白粉.请写出下反应的化学方程式为:
①实验室制备氯气
②工业制备氯气
③工业制备漂白粉
(2)漂白粉的水溶液与空气接触后才能体现漂白、杀菌作用,能说明其原理的化学方程式是
(3)已知二氧化硫和亚硫酸盐具有较强的还原性,亚硫酸的酸性比次氯酸的酸性强.若将少量的SO2通入漂白粉溶液中,有同学认为发生的反应为:Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO.你认为该同学的说法是否正确?
查看习题详情和答案>>
(1)工业上将氯气通入石灰乳制取漂白粉.请写出下反应的化学方程式为:
①实验室制备氯气
MnO2+4HCl
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl
MnCl2+Cl2↑+2H2O
;
| ||
②工业制备氯气
2NaCl+2H2O
2NaOH+Cl2↑+H2↑
| ||
2NaCl+2H2O
2NaOH+Cl2↑+H2↑
;
| ||
③工业制备漂白粉
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.(2)漂白粉的水溶液与空气接触后才能体现漂白、杀菌作用,能说明其原理的化学方程式是
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
.(3)已知二氧化硫和亚硫酸盐具有较强的还原性,亚硫酸的酸性比次氯酸的酸性强.若将少量的SO2通入漂白粉溶液中,有同学认为发生的反应为:Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO.你认为该同学的说法是否正确?
不正确
不正确
(填“正确”或“不正确”)请说明理由二氧化硫具有较强的还原性与具有强氧化性的次氯酸钙接触时将发生氧化还原反应
二氧化硫具有较强的还原性与具有强氧化性的次氯酸钙接触时将发生氧化还原反应
.瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)A仪器的名称是
(2)漂白粉将在U形管中产生,其化学方程式是
(3)此实验结果所得Ca(ClO)2产率太低.经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
②试判断另一个副反应(写出此反应方程式):
(4)漂粉精同盐酸作用产生氯气:Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,该反应中每生成1 mol Cl2,转移电子的物质的量为
查看习题详情和答案>>

(1)A仪器的名称是
分液漏斗
分液漏斗
,所盛试剂是浓盐酸
浓盐酸
,B中发生反应的化学方程式是MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
| ||
MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
.
| ||
(2)漂白粉将在U形管中产生,其化学方程式是
2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O
2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O
.(3)此实验结果所得Ca(ClO)2产率太低.经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
将U形管置于冷水浴中
将U形管置于冷水浴中
.②试判断另一个副反应(写出此反应方程式):
2HCl+Ca(OH)2=CaCl2+2H2O
2HCl+Ca(OH)2=CaCl2+2H2O
.为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置
在B、C之间增加一个饱和食盐水洗气装置
.(4)漂粉精同盐酸作用产生氯气:Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,该反应中每生成1 mol Cl2,转移电子的物质的量为
1
1
mol,被氧化的HCl的物质的量为1
1
mol.有效氯是漂粉精中有效Ca(ClO)2 的含量大小的标志.已知:有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量)×100%,该漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数为65.5%
65.5%
(保留一位小数).