网址:http://m.1010jiajiao.com/timu3_id_362161[举报]
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)近年来,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。根据你的化学知识作出如下判断:
当事人使用的液态洁污剂之一必定含氯,最可能的存在形式是 和 。当另一种具有 (性质)的液态洁污剂与之混合,可能发生如下反应而产生氯气:
。
(2)次氯酸盐的氧化性较强,可在碱性环境中将许多物质氧化,例如可用其将Fe3+氧化为新型杀菌消毒剂FeO42-,写出该反应的离子方程式 。
(3)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:
W(s)+I2(g)![]() WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。ks*5*u
|
|
|
|

则:①该反应的△H 0(填“>” 或“=”或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是![]()
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(4)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液后,溶液中离子浓度由大到小的顺序是 。
[不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(5)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl2(g)=MgCl2(s) △H= —641kJ/mol ②Ti(s)+2Cl2(g)=TiCl4(l) △H= —770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
查看习题详情和答案>>卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)近年来,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。根据你的化学知识作出如下判断:
当事人使用的液态洁污剂之一必定含氯,最可能的存在形式是 和 。当另一种具有 (性质)的液态洁污剂与之混合,可能发生如下反应而产生氯气:
。
(2)次氯酸盐的氧化性较强,可在碱性环境中将许多物质氧化,例如可用其将Fe3+氧化为新型杀菌消毒剂FeO42-,写出该反应的离子方程式 。
(3)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:
W(s)+I2(g)![]() WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。
|
|
|
|
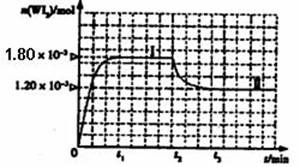
则:①该反应的△H 0(填“>” 或“=”或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是![]()
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(4)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液后,溶液中离子浓度由大到小的顺序是 。
[不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(5)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl2(g)=MgCl2(s) △H= —641kJ/mol ②Ti(s)+2Cl2(g)=TiCl4(l) △H= —770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
查看习题详情和答案>>(14分)高铁酸钾(K2FeO4)是一种集氧化、吸附、
絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新
型、高效、绿色环保的多功能水处理剂。近十几年
来,我国对高铁酸钾在饮用水处理中的应用的研究
也不断深入,已取得可喜成果。比较理想的制备方
法是次氯酸盐氧化法:先向KOH溶液中通入足量
Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,
得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾。
(1)向次氯酸钾强碱饱和溶液中加入三价铁盐发生反应的离子方程式:
①Fe3++3OH-=Fe(OH)3;② 。
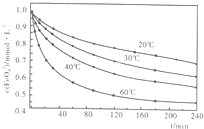
(2)高铁酸钾溶于水能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒,与此同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物。将适量K2Fe2O4溶液于pH=4.74的溶液中,配制成c(FeO2-4) =1.0mmol·L-1试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO2-4)的变化,结果见下图。高铁酸钾与水反应的离子反应方程式为 ,该反应的△H 0(填“>”“<”或“=”)。
(3)高铁酸盐还是一类环保型高性能电池的材料,用它做成的电池能量高,放电电流大,能长时间保持稳定的放电电压。高铁电池的总反应为:
 |
3Zn+2K2FeO4+8H2O 3Zn(OH)3+2Fe(OH)3+4KOH
该电池放电时的负极反应式为 ,若外电路有5.418×1022个电子通过,则正极有 g高铁酸钾参与反应。
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO-2与FeO2-4反应生成Fe(OH)3和CrO2-4
步骤3:加足量稀硫酸,使CrO2-4转化为Cr2O2-2,CrO-2转化为Cr3+,Fe(OH)3转化为Fe2+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2溶液V1mL。
①滴定时发生反应的离子方程式为 。
②原溶液中K2FeO4的浓度为 (用含字母的代数式表示)。 查看习题详情和答案>>
 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾.
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾.
(1)向次氯酸钾强碱饱和溶液中加入三价铁盐发生反应的离子方程式:
①Fe3++3OH-=Fe(OH);②______.
(2)高铁酸钾溶于水能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒,与此同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物.将适量K2Fe2O4溶液于pH=4.74的溶液中,配制成c(FeO2-4)=1.0mmol?L-1试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO+2-4)的变化,结果见图.高铁酸钾与水反应的离子反应方程式为______,该反应的△H______0(填“>”“<”或“=”).
(3)高铁酸盐还是一类环保型高性能电池的材料,用它做成的电池能量高,放电电流大,能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O  3Zn(OH)3+2Fe(OH)3+4KOH该电池放电时的负极反应式为______,若外电路有5.418×1022个电子通过,则正极有______g高铁酸钾参与反应.
3Zn(OH)3+2Fe(OH)3+4KOH该电池放电时的负极反应式为______,若外电路有5.418×1022个电子通过,则正极有______g高铁酸钾参与反应.
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO-2与FeO2-4反应生成Fe(OH)3和CrO2-4
步骤3:加足量稀硫酸,使CrO2-4转化为Cr2O2-7,CrO-2转化为Cr3+,Fe(OH)3转化为Fe2+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol?L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2溶液V1mL.
①滴定时发生反应的离子方程式为______.
②原溶液中K2FeO4的浓度为______(用含字母的代数式表示).
查看习题详情和答案>>
(1)向次氯酸钾强碱饱和溶液中加入三价铁盐发生反应的离子方程式:
①Fe3++3OH-=Fe(OH);②______.
(2)高铁酸钾溶于水能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒,与此同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物.将适量K2Fe2O4溶液于pH=4.74的溶液中,配制成c(FeO2-4)=1.0mmol?L-1试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO+2-4)的变化,结果见图.高铁酸钾与水反应的离子反应方程式为______,该反应的△H______0(填“>”“<”或“=”).
(3)高铁酸盐还是一类环保型高性能电池的材料,用它做成的电池能量高,放电电流大,能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O
| 放电 |
| 充电 |
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO-2与FeO2-4反应生成Fe(OH)3和CrO2-4
步骤3:加足量稀硫酸,使CrO2-4转化为Cr2O2-7,CrO-2转化为Cr3+,Fe(OH)3转化为Fe2+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol?L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2溶液V1mL.
①滴定时发生反应的离子方程式为______.
②原溶液中K2FeO4的浓度为______(用含字母的代数式表示).