网址:http://m.1010jiajiao.com/timu3_id_362160[举报]
产品标准号 | Q/320000JYJ03-2004 |
许可证号 | 食盐批字第100070号 |
配料表 | 精制盐、碘酸钾 |
含碘量 | 35±15 mg/kg |
卫生许可证号 | 苏食字(2005)第00015号 |
分装日期 | 见封口 |
储藏方法 | 通风、防潮 |
食用方法 | 根据烹调所需适量加入 |
食品标签认可号 | 苏食签(2002)007号 |
Ⅱ.下面是某网站上刊出的有关碘及碘的化合物的有关信息:
自然界中碘主要以碘化物和碘酸盐的形式存在。碘在海水中的含量甚微(5×10-8%),但海洋中某些生物如海带、海藻等具有选择性吸收和聚积碘的能力,因而干海藻是碘的一个重要来源。目前世界上碘主要来自智利硝石,其中含碘0.02%~1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在。通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液,但易溶于苯、四氯化碳等有机溶剂,紫色的碘蒸气有刺激性气味,能强烈刺激眼、耳、鼻、气管等黏膜,吸入较多的碘蒸气会发生中毒,甚至造成死亡。碘遇淀粉(面粉的主要成分)会出现明显的蓝色。碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性:?
2NaI+3H2SO4+MnO2![]() 2NaHSO4+MnSO4+2H2O+I2 ①
2NaHSO4+MnSO4+2H2O+I2 ①
2NaIO3+5NaHSO3![]() 2NaSO4+3NaHSO4+H2O+I2 ②
2NaSO4+3NaHSO4+H2O+I2 ②
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应。?
根据以上信息,完成下列问题:?
(1)反应①反应②的离子方程式是(亚硫酸氢钠的电离方程式是:NaHSO3![]() H++HSO
H++HSO![]() )
)
反应①:________________________________ ;?
反应②:________________________________ ;?
I2在反应①中是_______(填“氧化”或“还原”,下同)产物,在反应②中是_______产物。?
(2)请你设计实验探究上述“淮牌”精制盐中是否真的含有碘元素。?
实验名称:探究“淮牌”精制盐中是否含有碘元素?
实验目的:?
a.认识碘酸钾中的碘元素转变成碘单质的化学反应;?
b.________________________________ 。?
实验原理:(提示:结合题中信息和实验目的进行分析)________________________。?
实验用品:(提示:实验用品通常包括仪器和药品,根据你设计的实验填写)________________。?
实验步骤:(用准确、简洁的语言填写下表)
实验步骤 | 实验现象 | 化学方程式或实验结论 |
| 固体在水中溶解 |
|
| 溶液出现棕黄色 | — |
|
| “淮牌”精制盐中含有碘元素 |
问题讨论:某地有100多千米的海岸线,海产品丰富,海产品中或多或少的含有碘元素,而海产品又是该地方人的主要副食品,该地方人的食用盐中需要加碘吗?说明你的理由。
查看习题详情和答案>>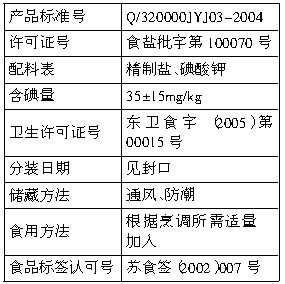
Ⅱ.下面是某网站上刊出的有关碘及其化合物的有关信息。
自然界中碘主要以碘化物和碘酸盐的形式存在。碘在海水中的含量甚微,但海洋中某些生物如海带、海藻等具有选择性吸收和聚集碘的能力,因而干海藻是碘的一个重要来源。目前世界上碘主要来自于智利硝石,其中含碘0.02%~1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在。通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液,但易溶于苯、四氯化碳等有机溶剂,紫色的碘蒸气有刺激性气味,能强烈刺激眼、耳、鼻、气管等黏膜,吸入较多的碘蒸气会发生中毒,甚至造成死亡。碘遇淀粉(面粉的主要成分)会出现明显的蓝色。碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性:
①2NaI+3H2SO4+MnO2=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应。
根据以上信息,回答下列问题:
(1)写出有关反应的离子方程式(已知:NaHSO3=Na++ HSO3-):反应①:__________;反应②:________;I2在反应①中是______________(填“氧化”或“还原”,下同)产物,在反应②中是__________________产物。
(2)请你设计实验探究上述“淮牌”精制盐中是否真的含有碘元素。
实验名称:探究“淮牌”精制盐中是否含有碘元素。
实验目的:1.认识碘酸钾中的碘元素转变成碘单质的化学反应;
2._________________________。
实验原理:____________________(提示:结合题中信息和实验目的进行分析)。
实验用品:____________________(提示:实验用品通常包括仪器和药品,根据你设计的实验填写)。
实验步骤:(用准确、简洁的语言填写下表)
 查看习题详情和答案>>
查看习题详情和答案>>
A.(1)K3[Fe(CN)6]铁氰化钾又叫赤血盐.是深红色斜方晶体,易溶于水,无特殊气味,能溶于水、丙酮,不溶于乙醇.
①分子内不含有______(填序号).
A.离子键 B.极性键 C.金属键D.配位键 E.氢键 F.非极性键
②中心离子的基态电子排布式______.
③配位体CN-的等电子体有______(写出两种).
④用价电子对互斥理论可知二氧化硒分子的空间构型为______.
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As______Se(填“>”、“<”或“=”).
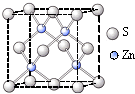
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是______.
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解.向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失.
步骤II:在暗处放置30min,并不时轻轻摇动.30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内.
步骤Ⅲ:加入指示剂,用0.1mol?L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点.
测定过程中发生的相关反应如下:
①
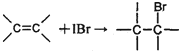
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是______,碘瓶不干燥会发生反应的化学方程式______.
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是______.
(3)步骤Ⅲ中所加指示剂为______,滴定终点的现象______.
A.(1)K3[Fe(CN)6]铁氰化钾又叫赤血盐.是深红色斜方晶体,易溶于水,无特殊气味,能溶于水、丙酮,不溶于乙醇.
①分子内不含有______(填序号).
A.离子键 B.极性键 C.金属键D.配位键 E.氢键 F.非极性键
②中心离子的基态电子排布式______.
③配位体CN-的等电子体有______(写出两种).
④用价电子对互斥理论可知二氧化硒分子的空间构型为______.
(2)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As______Se(填“>”、“<”或“=”).
②硫化锌的晶胞中(结构如右图所示),硫离子的配位数是______.

B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解.向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失.
步骤II:在暗处放置30min,并不时轻轻摇动.30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内.
步骤Ⅲ:加入指示剂,用0.1mol?L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点.
测定过程中发生的相关反应如下:

①

②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是______,碘瓶不干燥会发生反应的化学方程式______.
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是______.
(3)步骤Ⅲ中所加指示剂为______,滴定终点的现象______.
查看习题详情和答案>>
I、下表是如东某超市出售的“淮牌”加碘精制盐的有关说明:

II、下面是某网站上刊出的有关碘及碘的化合物的有关信息:
自然界中碘主要以碘化物和碘酸盐的形式存在.碘在海水中的含量甚微(5×10-8%),但海洋中某些生物如海带、海藻等具有选择性吸收和聚积碘的能力,因而干海藻是碘的一个重要来源.目前世界上碘主要来自智利硝石,其中含碘0.02%~1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在.通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液,但易溶于苯、四氯化碳等有机溶剂,紫色的碘蒸气有刺激性气味,能强烈刺激眼、耳、鼻、气管等粘膜,吸入较多的碘蒸气会发生中毒,甚至造成死亡.碘遇淀粉(面粉的主要成分)会出现明显的蓝色.碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性:
2NaI+3H2SO4+MnO2=2NaHSO4+MnSO4+2H2O+I2…………⑴
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2…………⑵
反应⑴是自海藻灰中提取碘的主要反应,反应⑵是自智利硝石中提取碘的主要反应.
根据以上信息,回答下列问题:
⑴反应⑴、反应⑵的离子方程式是(亚硫酸氢钠的电离方程式是:NaHSO3=H++HSO3-)反应⑴:________;反应⑵:________;I2在反应⑴中是________(填“氧化”或“还原”,下同)产物,在反应⑵中是________产物;
⑵请你设计实验探究上述“淮牌”精制盐中是否真的含有碘元素.
实验名称:探究“淮牌”精制盐中是否含有碘元素
实验目的:1.认识碘酸钾中的碘元素转变成碘单质的化学反应;
2.________.
实验原理:(提示:结合题中信息和实验目的进行分析)________.
实验用品:(提示:实验用品通常包括仪器和药品,根据你设计的实验填写)________.
实验步骤:(用准确、简洁的语言填写下表)

问题讨论:如东有100多km的海岸线,海产品丰富,海产品中或多或少的含有碘元素,而海产品又是如东人的主要副食品,如东人的食用盐中需要加碘吗?说明你的理由.