摘要:掌握鉴别氯.溴.碘和卤化物的技能.
网址:http://m.1010jiajiao.com/timu3_id_362153[举报]
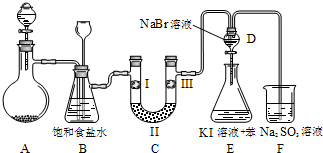 如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).(1)制备氯气选用的药品为:漂粉精固体
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
下列说法正确的是( )
| A、许多国家十分重视海水资源的综合利用,不需要化学变化就可以从海水中获得氯、溴、碘、食盐、水等物质 | B、金属冶炼中涉及到的反应类型有:氧化还原反应、复分解反应、分解反应、置换反应 | C、淀粉、纤维素的分子式都是(C6H1005)n,因此互称为同分异构体 | D、丙烷和异丁烷互称同系物 |
 (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.(1)在光照条件下.氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl …
反应②中形成的化合物的电子式为


非极性
非极性
键(填“极性”或“非极性”).(2)在短周期主族元素中,氯元素及与其相邻元素的原予半径从大到小的顺序是
S>Cl>F
S>Cl>F
.(用元素符号表示).与氯元素同周期且金属性最强的元素位于周期表的第
三
三
周期IA
IA
族.(3)卤索单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是
a
a
.a.卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深
b?卤化氢的键长按H-F、H-Cl、H-Br、H-I的顺序依次减小
c?卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d?卤索单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
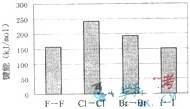
(4)卤素单质的键能大小如图.由图推断:
①非金属性强的卤素,其单质分子的化学键
不一定容易
不一定容易
断裂(填“容易”或“不容易”或“不一定容易”).②卤素单质键能大小与键长的关系为:
除F2外.键长增大,键能减小
除F2外.键长增大,键能减小
.为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验).

实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸.
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
III.当B中溶液由黄色变为棕红色时,关闭活塞a.
IV.…
(1)烧瓶A制取气体的化学方程式是
(2)证明氯气的氧化性强于碘的实验现象是
离子方程式:
(3)B中溶液发生反应的离子方程式是
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
(5)D中溶液发生反应的离子方程式是
(6)氯、溴、碘单质的氧化性逐渐减北的原因:同主族元素从上到下
查看习题详情和答案>>

实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸.
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
III.当B中溶液由黄色变为棕红色时,关闭活塞a.
IV.…
(1)烧瓶A制取气体的化学方程式是
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
.(2)证明氯气的氧化性强于碘的实验现象是
淀粉KI试纸变蓝
淀粉KI试纸变蓝
.离子方程式:
Cl2+2I-=I2+2Cl-
Cl2+2I-=I2+2Cl-
.(3)B中溶液发生反应的离子方程式是
Cl2+2Br-=Br2+2Cl-
Cl2+2Br-=Br2+2Cl-
.(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D震荡.静至后CCl4层溶液变为紫(或紫红)色
打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D震荡.静至后CCl4层溶液变为紫(或紫红)色
.(5)D中溶液发生反应的离子方程式是
Br2+2I-=I2+2Br-
Br2+2I-=I2+2Br-
.(6)氯、溴、碘单质的氧化性逐渐减北的原因:同主族元素从上到下
电子层数依次增多,原子半径逐渐增大,
电子层数依次增多,原子半径逐渐增大,
,得电子能力逐渐减弱.下表是五种银盐的溶度积常数(25℃):
|
| A、五种物质在常温下溶解度最大的是Ag2SO4 |
| B、将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀 |
| C、对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大 |
| D、沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 |