摘要:怎样软化含Mg(HCO3)2的硬水.写出有关反应式 知识点:硬水的软化方法. 能力点:综合能力
网址:http://m.1010jiajiao.com/timu3_id_362132[举报]
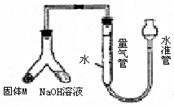
 某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.
某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.(1)如何检验该装置的气密性
安装好装置并在量气管内加水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装量密封(合理即给分)
安装好装置并在量气管内加水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装量密封(合理即给分)
.(2)样品与氢氧化钠溶液反应的离子方程式:
2OH-+2Al+6H2O=2[AI(OH)4]-+3H2↑(或2OH-+2Al+2H2O=2AlO2-+3H2↑)
2OH-+2Al+6H2O=2[AI(OH)4]-+3H2↑(或2OH-+2Al+2H2O=2AlO2-+3H2↑)
.(3)使足量氢氧化钠溶液与ag合金(固体M)充分反应,进入量气管的气体体积为VmL(已换算成标准状况,下同).若a=0.036,V=22.4,该合金中铝的质量分数是
50%或0.5
50%或0.5
.(4)若将装置中的氢氧化钠替换为足量的盐酸,与ag合金粉末充分反应,则进入量气管内的气体体积
>
>
(填“>”“<”“=”)VmL;利用此方法测得的气体体积能否进行铝的含量计算?能
能
(填“能”或“否”)某合金,除Cu外还含有Mg、Al、Zn中的二种或三种.某小组设计实验探究该合金组成,所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3?H2O.该小组探究过程如下:
查阅资料:
①Mg、Al、Zn都是白色金属,Cu为光亮红色金属;
②锌可以与NaOH溶液反应生成H2,Zn转化为ZnO22-离子;
③Zn(OH)2白色固体,难溶于水,可溶于强碱及NH3?H2O;
④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+;
⑤Cu与稀H2SO4或NaOH溶液不反应.
提出假设:
(1)假设1:该合金中除Cu外还含 金属.
(2)假设2:该合金中除Cu外还含 金属.
(3)假设3:该合金中除Cu外还含 金属.
(4)假设4:该合金中除Cu外还含Mg、Al、Zn三种金属.
实验探究:
甲、乙同学基于假设4分别设计实验方案如下:

(5)试剂M是 (填化学式)沉淀C是 (填化学式).
(6)写出操作I形成络合物的离子反应式: 、 .
(7)丙同学研究了甲、乙两同学的方案后,用最简介的方法测定了Wg样品中的Mg、Cu质量分数,他的方法是: .
查看习题详情和答案>>
查阅资料:
①Mg、Al、Zn都是白色金属,Cu为光亮红色金属;
②锌可以与NaOH溶液反应生成H2,Zn转化为ZnO22-离子;
③Zn(OH)2白色固体,难溶于水,可溶于强碱及NH3?H2O;
④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+;
⑤Cu与稀H2SO4或NaOH溶液不反应.
提出假设:
(1)假设1:该合金中除Cu外还含
(2)假设2:该合金中除Cu外还含
(3)假设3:该合金中除Cu外还含
(4)假设4:该合金中除Cu外还含Mg、Al、Zn三种金属.
实验探究:
甲、乙同学基于假设4分别设计实验方案如下:

(5)试剂M是
(6)写出操作I形成络合物的离子反应式:
(7)丙同学研究了甲、乙两同学的方案后,用最简介的方法测定了Wg样品中的Mg、Cu质量分数,他的方法是:
Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁.
(1)正常人每天应补充14mg左右的铁.其中绝大部分来自于食物.如果全部通过服用含FeSO4?7H2O的片剂来补充铁,则正常人每天服需用含 mg FeSO4?7H2O的片剂.
(2)“速力菲”是市场上一种常见的补铁药物,其中Fe2+的含量为35.0%.该药品中的Fe2+会缓慢氧化.国家规定该药物中Fe2+的氧化率超过10%即不能再服用.为检验某药店出售的“速力菲”是否失效,取10.00g该药品全部溶于稀硫酸,配制成1000mL溶液.取其中20.00mL,用0.01000mol/L KMnO4溶液滴定,用去KMnO4溶液24.00mL.通过计算说明该药物是否能服用?(MnO4-在酸性条件下的还原产物为Mn2+,药品中除Fe元素外的其他成分不与KMnO4反应) .
查看习题详情和答案>>
(1)正常人每天应补充14mg左右的铁.其中绝大部分来自于食物.如果全部通过服用含FeSO4?7H2O的片剂来补充铁,则正常人每天服需用含
(2)“速力菲”是市场上一种常见的补铁药物,其中Fe2+的含量为35.0%.该药品中的Fe2+会缓慢氧化.国家规定该药物中Fe2+的氧化率超过10%即不能再服用.为检验某药店出售的“速力菲”是否失效,取10.00g该药品全部溶于稀硫酸,配制成1000mL溶液.取其中20.00mL,用0.01000mol/L KMnO4溶液滴定,用去KMnO4溶液24.00mL.通过计算说明该药物是否能服用?(MnO4-在酸性条件下的还原产物为Mn2+,药品中除Fe元素外的其他成分不与KMnO4反应)
(8分) Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。
⑴ 正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含 mg FeSO4·7H2O的片剂。
⑵ “速力菲”是市场上一种常见的补铁药物,其中Fe2+的含量为35.0%。该药品中Fe2+会缓慢氧化。国家规定该药物中Fe2+的氧化率超过10%即不能再服用。为检验某药店出售的“速力菲”是否失效,取10.00g该药品全部溶于稀硫酸,配制成1000mL溶液。取其中20.00mL,用0.01000 mol/L KMnO4溶液滴定,用去KMnO4溶液24.00mL。通过计算说明该药物是否能服用?(MnO4-在酸性条件下的还原产物为Mn2+,药品中除Fe元素外其他成分不与KMnO4反应)
查看习题详情和答案>>