网址:http://m.1010jiajiao.com/timu3_id_362099[举报]
A.醋酸逸出气泡快,镁粉溶解也快,说明溶液中氢离子浓度大
B.在醋酸里反应速率慢,溶液中存在着CH3COOHƒCH3COO-+H+醋酸的电离平衡,与镁反应会使平衡移动
C.开始时两酸反应速度相同,随着与镁反应,醋酸逐渐加快,离子反应为Mg+2CH3COOH══Mg2++2CH3COO-+H2↑
D.盐酸反应速度快,离子方程式为Mg+2H+══Mg2++H2↑
查看习题详情和答案>>
同物质的量浓度的盐酸和醋酸,分别跟同种情况的镁粉反应,反应现象和归纳的实验结论都是正确的是( )
A.醋酸逸出气泡快,镁粉溶解也快,说明溶液中氢离子浓度大
B.在醋酸里反应速率慢,溶液中存在着CH3COOHƒCH3COO-+H+醋酸的电离平衡,与镁反应会使平衡移动
C.开始时两酸反应速度相同,随着与镁反应,醋酸逐渐加快,离子反应为Mg+2CH3COOH══Mg2++2CH3COO-+H2↑
D.盐酸反应速度快,离子方程式为Mg+2H+══Mg2++H2↑
查看习题详情和答案>>
|
最近有人用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-.这个反应看起来很陌生,但反应类型却跟下列一个化学反应相似,你认为该反应是 | |
| [ ] | |
A. |
Mg+2HCl==MgCl2+H2↑ |
B. |
NaOH+HCl=NaCl+H2O |
C. |
NH3+HCl=NH4Cl |
D. |
H2O+CH3COOH |
|
最近有人用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-.这个反应看起来很陌生,但反应类型上却可以跟下列一个化学反应相似,你认为该反应是 | |
| [ ] | |
A. |
NH3+HCl=NH4Cl |
B. |
NaOH+HCl=NaCl+H2O |
C. |
Mg+2HCl=MgCl2+H2↑ |
D. |
H2O+CH3COOH |
(18分)Ⅰ测定水中溶解氧的方法是:在水中加入硫酸锰及氢氧化钠和碘化钾溶液,生成氢氧化锰沉淀。氢氧化锰性质极不稳定,迅速与水中溶解氧化合生成锰酸锰:
2MnSO4+4NaOH=2Mn(OH)2↓+2Na2SO4--------------①
2Mn(OH)2+O2=2H2MnO3---------------------------②
H2MnO3十Mn(OH)2=MnMnO3↓+2H2O------③
加入硫酸溶液,使沉淀(MnMnO3)与溶液中所加入的碘化钾发生反应,
2KI+H2SO4=2HI+K2SO4--------------------------- --------④
MnMnO3+2H2SO4+2HI=2MnSO4+I2+3H2O ----—⑤
用已知浓度的Na2S2O3溶液滴定生成的碘,根据消耗的Na2S2O3的体积可以测定水中溶氧量(mg/L)
I2+2Na2S2O3=2NaI+Na2S4O6
测定中,用移液管取50.00 mL水样,迅速加入预先配置好的MnSO4和NaOH混合溶液,再加入KI溶液,立即塞好塞子,震荡使反应完全。打开塞子,迅速加入适量的稀硫酸,期间发生①—⑤反应生成单质碘。用0.10mol/LNa2S2O3溶液滴定生成的碘,消耗了2.68mL Na2S2O3溶液。
已知:H2S2O3 为弱酸
回答下列问题:
(1)盛放Na2S2O3溶液的滴定管种类为
(2)该滴定的指示剂为 ,滴定时,溶液由 色到 色,且半分钟内颜色不再变化即达到滴定终点
(3)下列操作和该滴定有关并会导致测定水中溶氧偏高的是( )
A滴定前滴定管尖嘴无气泡,滴定结束尖嘴有气泡 B锥形瓶用待装液润洗
C滴定管读数开始平视,滴定结束时立即平视读数 D酸式滴定管没有用待装液润洗
(4)水中溶氧量为 mg/L水。
Ⅱ50.00mL0.50mol/L盐酸跟50.0mL0.55mol/L氢氧化钠溶液在下图装置中进行中和反应,通过测定反应前盐酸和氢氧化钠溶液各自的温度和中和过程中混合液的最高温度可计算中和热.试回答下列问题.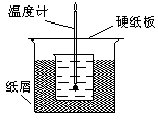
(1)该实验装置设计中缺少的仪器的名称为
(2)若实验测得放出热量为1.43kJ,写出表示中和热的热化学方程式
(3)改用60.0mL0.5mol/L盐酸跟50.0mL0.55mol/L氢氧化钠溶液进行反应,与上述实验相比,所放热量 等,所求中和热数值 等。(填“相等,不相等”)