摘要:某温度下.在一定体积的密闭容器里适量的NH3(气)和Cl2(气)恰好完全反应.若反应产物只有N2(气)和NH4Cl(固).则反应前后容器内压强比应接近于( ) A.1∶11 B.11∶1 C.7∶11 D.11∶7 该题涉及了NH3.Cl2性质.气态方程及阿佛加德罗定律.要求学生能综合运用这些知识解题.
网址:http://m.1010jiajiao.com/timu3_id_361714[举报]
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为
 ;
;
(2)反应是
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)?c(CH2)=c(CO)?c(H2O),试判断此时的温度为
查看习题详情和答案>>
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为


(2)反应是
吸热
吸热
反应.(选填“吸热”、放热).(3)能判断该反应是否达到化学平衡状态的依据是
bc
bc
.a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)?c(CH2)=c(CO)?c(H2O),试判断此时的温度为
830
830
℃ 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表,回答下列问题:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表,回答下列问题:| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
>
>
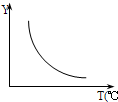
0;若该反应符合如图所示的关系,则在图中,Y轴是指CO2或H2的百分含量等
CO2或H2的百分含量等
. (答出一种即可)(2)能判断该反应达到化学平衡状态的依据是
bc
bc
(多选扣分).a.容器中压强不变 b.混合气体中c(CO)不变
c.v(H2)正=v(H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9?c(CO2)?c(H2)=c(CO)?c(H2O),由此可以判断此时的温度为
800
800
℃.其它条件不变,升高温度,原化学平衡向逆
逆
反应方向移动(填“正”或“逆”),容器内混合气体的平均相对分子质量不变
不变
(填“增大”、“减小”或“不变”).在一定体积的密闭容器中,进行反应CO2(g)+H2(g)?CO(g)+H2O(g).其平衡常数K和温度T的关系如表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)能判断该反应达化学平衡状态的依据是
A:容器中压强不变 B:混合气体中c(CO)不变
C:V(H2)正=V(H2O)逆 D:c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O)试判断此时的温度
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2) 为2mol/L,c(H2)为1.5mol/L,c(CO) 为1mol/L,c(H2O)为3mol/L,则此时刻反应向
查看习题详情和答案>>
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
(2)该反应为
吸热
吸热
反应(填“吸热”或“放热”)(3)能判断该反应达化学平衡状态的依据是
BC
BC
A:容器中压强不变 B:混合气体中c(CO)不变
C:V(H2)正=V(H2O)逆 D:c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O)试判断此时的温度
830℃
830℃
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2) 为2mol/L,c(H2)为1.5mol/L,c(CO) 为1mol/L,c(H2O)为3mol/L,则此时刻反应向
逆向
逆向
(填“正向”或“逆向”)进行.在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应为
(2)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
查看习题详情和答案>>
CO2(g)+H2(g)?CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为
吸热
吸热
反应(选填吸热、放热).(2)能判断该反应是否达到化学平衡状态的依据是
bc
bc
.a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
830
830
℃.在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
;
(2)该反应为
(3)某温度下,平衡浓度符合下式:3c(CO2)?c(H2)=5c(CO)?c(H2O),试判断此时的温度为
(4)830℃时,向该容器中加入1L CO2与1L H2,平衡时CO2的体积分数是
查看习题详情和答案>>
CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
(2)该反应为
吸热
吸热
反应(选填吸热、放热);(3)某温度下,平衡浓度符合下式:3c(CO2)?c(H2)=5c(CO)?c(H2O),试判断此时的温度为
700
700
℃;(4)830℃时,向该容器中加入1L CO2与1L H2,平衡时CO2的体积分数是
25%
25%
.