摘要:21.已知A.B分别为两种盐.I为金属单质.J为空气中一主要成分的单质.根据下列框图变化.推断:AgNO3+HCl==AgCl↓+HNO3 ⑴写出下列物质的化学式:A B F H G ⑵写出C的分子构型 D的结构式 E的电子式 分子构型 ⑶写出下列反应的离子方程式: ①M+N+D白色胶状沉淀: ②P+N白色胶状沉淀:
网址:http://m.1010jiajiao.com/timu3_id_361660[举报]
(2012?唐山二模)图中,A~L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见的金属单质,E的稀溶液为蓝色,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味的气体,且能使品红溶液褪色.
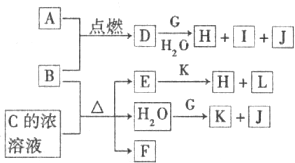
回答下列问题:
(1)A元素在周期表中的位置是
(2)①D的水溶液与G反应的离子方程式为
②A和K是重要的化工原料,工业上同时制取A单质和K的反应的化学方程式为
(3)若将标准状况下2.24L的F通入150mL 1.0m1?L-1的K溶液中,充分反应后,测得溶液显酸性,所得溶质及其物质的量分别为
(4)与F组成元素相同的一种-2价酸根离子M,M中两种元素的质量比为4:3,已知1mol A单质与含1mol M的溶液能恰好完全反应,反应时仅观察到有浅黄色沉淀产生.取反应后的上层清液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.则A单质与含M的溶液反应的离子方程式为
查看习题详情和答案>>

回答下列问题:
(1)A元素在周期表中的位置是
第3周期ⅦA族
第3周期ⅦA族
(填所在周期和族),K固体中所含的化学键有离子键和共价键(或极性共价键)
离子键和共价键(或极性共价键)
.(2)①D的水溶液与G反应的离子方程式为
Cu2++2H2O+2Na═Cu(OH)2↓+2Na++H2↑
Cu2++2H2O+2Na═Cu(OH)2↓+2Na++H2↑
.②A和K是重要的化工原料,工业上同时制取A单质和K的反应的化学方程式为
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
(3)若将标准状况下2.24L的F通入150mL 1.0m1?L-1的K溶液中,充分反应后,测得溶液显酸性,所得溶质及其物质的量分别为
Na2SO3为0.05mol,NaHSO3为0.05mol
Na2SO3为0.05mol,NaHSO3为0.05mol
.(4)与F组成元素相同的一种-2价酸根离子M,M中两种元素的质量比为4:3,已知1mol A单质与含1mol M的溶液能恰好完全反应,反应时仅观察到有浅黄色沉淀产生.取反应后的上层清液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.则A单质与含M的溶液反应的离子方程式为
Cl2+S2O32-+H2O═2Cl-+2H++S↓+SO42-
Cl2+S2O32-+H2O═2Cl-+2H++S↓+SO42-
. 硫酸和硝酸是工业上具有重要用途的强酸.目前我国分别采用接触法和氨的催化氧化法制取硫酸和硝酸.下图表示的物质之间的转化关系中,虚线框内可分别表示硫酸、硝酸工业制法的生产流程,虚线框外是其他物质之间的相互转化(部分反应物、生成物没有列出).已知A是由两种元素组成的化合物,B是能使带有余烬的木条复燃的气体单质,E是硫酸或硝酸.J是日常生活中用途最多的、但在下列(1)、(2)两种情况中不同的金属单质.
硫酸和硝酸是工业上具有重要用途的强酸.目前我国分别采用接触法和氨的催化氧化法制取硫酸和硝酸.下图表示的物质之间的转化关系中,虚线框内可分别表示硫酸、硝酸工业制法的生产流程,虚线框外是其他物质之间的相互转化(部分反应物、生成物没有列出).已知A是由两种元素组成的化合物,B是能使带有余烬的木条复燃的气体单质,E是硫酸或硝酸.J是日常生活中用途最多的、但在下列(1)、(2)两种情况中不同的金属单质.依据上述信息,回答下列问题:
(1)若E的相对分子质量比D大17,G是一种活泼金属单质,则:
①反应①的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
;
| ||
| △ |
②反应②的离子方程式为
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(2)若E的相对分子质量比D大18,I是一种盐,反应②是化合反应,且A、F、I、J、K中含有同一种金属元素,则:
①A的组成元素为
S、Fe
S、Fe
;②反应②的离子方程式为
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.