摘要:26.SO2 SO3
网址:http://m.1010jiajiao.com/timu3_id_361556[举报]
硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发达水平的一种标志.目前的重要生产方法是“接触法”,有关接触氧化反应:2SO2+O2
2SO3的说法不正确的是( )
| 催化剂 |
| △ |
查看习题详情和答案>>
 硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)| 催化剂 | △ |
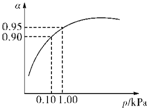
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.根据图示回答下列问题:
(1)将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数等于
800
800
.(不需要写表达式)(2)平衡状态由A变到B时,平衡常数K(A)
=
=
K(B)(填“>”、“<”或“=”).(3)此反应在恒温密闭的装置中进行的,能充分说明此反应已达到平衡的标志是:
AD
AD
(填字母)A.接触室中气体的平均相对分子质量不再改变
B.接触室中SO2、O2、SO3的浓度相同
C.接触室中SO2、SO3的物质的量之比为2:1:2
D.接触室中压强不随时间变化而变化.
硫酸的消费量常被视为一个国家工业发达水平的标志.我国主要以黄铁矿(FeS2)为原料采用接触法生产硫酸.其主要涉及到的反应有(没有配平)A.FeS2+O2→Fe2O3+SO2 B. SO2(g)+O2 (g)→SO3(g) C.SO3+H2O→H2SO4
回答下列问题:
(1)已知FeS2与足量氧气反应生成1molSO2时放出426.5kJ的热量.则其反应的热化学方程式为
(2)已知某温度时反应B的平衡常数为800.在体积恒为10L的密闭容器中充入10mol SO2、30mol O2和10mol SO3,反应开始将向
A.容器内压强不变 B.混合气体的密度不变 C.v正(SO2)=2v正(O2)
D.c(SO2):c(O2):c(SO3)=2:1:2 E.混合气体的摩尔质量不变
(3)反应A的副产物Fe2O3是铁锈的主要成分.N2H4(肼)能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可以减缓锅炉锈蚀.若反应过程中肼转化为氮气,每生成1mol Fe3O4,转移电子的物质的量为
(4)铁盐溶液可以洗涤做过银镜实验的试管,原理是Fe3++Ag(s)?Fe2++Ag+.甲同学将银粉加入到Fe2(SO4)3溶液中进行了实验,观察到的现象是
(5)用10mol/L的浓硫酸配制2mol/L的稀硫酸,所用的玻璃仪器除量筒和玻璃棒外,还有
A.容量瓶 B.烧杯 C.烧瓶 D.胶头滴管.
查看习题详情和答案>>
回答下列问题:
(1)已知FeS2与足量氧气反应生成1molSO2时放出426.5kJ的热量.则其反应的热化学方程式为
4FeS2(s)+11O2(g)
2Fe2O3(s)+8SO2(g)△H=-3412kJ/mol
| ||
4FeS2(s)+11O2(g)
2Fe2O3(s)+8SO2(g)△H=-3412kJ/mol
.
| ||
(2)已知某温度时反应B的平衡常数为800.在体积恒为10L的密闭容器中充入10mol SO2、30mol O2和10mol SO3,反应开始将向
正
正
(填“正”或“逆”)方向进行.在该容器中,能说明该反应已达到平衡状态的依据是A、E
A、E
(填字母序号)A.容器内压强不变 B.混合气体的密度不变 C.v正(SO2)=2v正(O2)
D.c(SO2):c(O2):c(SO3)=2:1:2 E.混合气体的摩尔质量不变
(3)反应A的副产物Fe2O3是铁锈的主要成分.N2H4(肼)能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可以减缓锅炉锈蚀.若反应过程中肼转化为氮气,每生成1mol Fe3O4,转移电子的物质的量为
1mol
1mol
,需要消耗肼的质量为8
8
g.(4)铁盐溶液可以洗涤做过银镜实验的试管,原理是Fe3++Ag(s)?Fe2++Ag+.甲同学将银粉加入到Fe2(SO4)3溶液中进行了实验,观察到的现象是
银粉逐渐溶解,溶液由棕黄色逐渐变为浅绿色,溶液出现白色沉淀
银粉逐渐溶解,溶液由棕黄色逐渐变为浅绿色,溶液出现白色沉淀
.丙同学认为向试管中加入几块铅笔芯也有利于除去银,你认为他的理由是银与铅笔中的石墨在溶液中形成了原电池,银为负极,石墨为正极,加快了反应速率
银与铅笔中的石墨在溶液中形成了原电池,银为负极,石墨为正极,加快了反应速率
.(5)用10mol/L的浓硫酸配制2mol/L的稀硫酸,所用的玻璃仪器除量筒和玻璃棒外,还有
A、B、D
A、B、D
A.容量瓶 B.烧杯 C.烧瓶 D.胶头滴管.
 硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.(1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4.该过程的化学方程式可表示为
SO2+V2O5?V2O4+SO3
SO2+V2O5?V2O4+SO3
.(2)为测定过程中混合气的SO2体积分数,选用0.0500mol/LI2的标准溶液、淀粉溶液进行测定.已知:V(耗用I2标准溶液)=10.00mL,V(采集烟气)=100.0mL(已折算为标准状况),则烟气中SO2的体积分数为
0.112
0.112
.(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.试分析工业生产中采用常压的原因是
在常压时,SO2的转化率已很高,若加压,则对设备、能源等有较高的要求,经济上不划算
在常压时,SO2的转化率已很高,若加压,则对设备、能源等有较高的要求,经济上不划算
.(4)在温度相同、体积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下.
已知:2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molSO2、1molO2 | 2molSO3 | mmolSO2、nmolO2、pmolSO3 |
| c(SO3)/mol?L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
1
1
,p=1.6
1.6
mol,b+c=39.32
39.32
kJ.SO2被空气氧化生成SO3是个放热的可逆反应.实验室根据该反应设计如图所示实验装置来制备SO3固体.请完成下列问题:
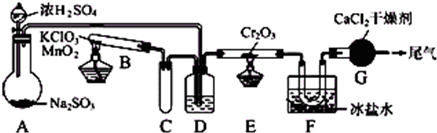
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸.加几滴水的作用是
(3)小试管C的作用是
(4)广口瓶D内盛的试剂是浓硫酸,装置D的三个作用是:
①
(5)装置G的作用是
查看习题详情和答案>>

(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)
检查装置的气密性
检查装置的气密性
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸.加几滴水的作用是
水与浓硫酸作用放热,有利于SO2的放出
水与浓硫酸作用放热,有利于SO2的放出
(3)小试管C的作用是
缓冲、防止D中的液体倒吸到B中
缓冲、防止D中的液体倒吸到B中
(4)广口瓶D内盛的试剂是浓硫酸,装置D的三个作用是:
①
干燥SO2和O2
干燥SO2和O2
②使SO2和O2混合均匀
使SO2和O2混合均匀
③通过观察控制气体比例和气流速度
通过观察控制气体比例和气流速度
(5)装置G的作用是
防止外界水蒸气进入与SO3反应
防止外界水蒸气进入与SO3反应
.