网址:http://m.1010jiajiao.com/timu3_id_361280[举报]
已知X和Y各是由两种常见元素组成的化合物,A.B为气体,G为白色沉淀,F是一种两性氢氧化物,在电解开始时,溶液中有白色 沉淀产生,但随着电解的进行,白色沉淀逐渐溶解,最后变为澄清溶液C(有两种溶质),X.W.C.E的焰色反应均为黄色。各物质之间的关系如图所示(部分产物已经省略,除气体间的反应外,其余反应均在溶液中进行)。
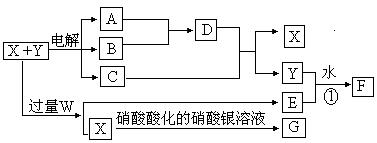
(1)X、Y、W的化学式分别为 . .
(2)写出反应①的离子方程式
(3)A与B反应生成1 mol D时放出热量为92.3 kJ,则此反应的热化学方程式为 。
(4)向澄清溶液C中加入10 mol·L-1的硫酸,当加至50 mL时才开始出现沉淀,假设电解过程中溶液体积变化忽略不计,原X和Y混合液的体积为100 mL,Y溶液的物质的量浓度为a mol·L-1,则X溶液的物质的量浓度为 mol·L-1(含a代数式表示)。
查看习题详情和答案>>已知X和Y各是由两种常见元素组成的化合物,A.B为气体,G为白色沉淀,F是一种两性氢氧化物,在电解开始时,溶液中有白色 沉淀产生,但随着电解的进行,白色沉淀逐渐溶解,最后变为澄清溶液C(有两种溶质),X.W.C.E的焰色反应均为黄色。各物质之间的关系如图所示(部分产物已经省略,除气体间的反应外,其余反应均在溶液中进行)。

(1)X、Y、W的化学式分别为 . .
(2)写出反应①的离子方程式
(3)A与B反应生成1 mol D时放出热量为92.3 kJ,则此反应的热化学方程式为 。
(4)向澄清溶液C中加入10 mol·L-1的硫酸,当加至50 mL时才开始出现沉淀,假设电解过程中溶液体积变化忽略不计,原X和Y混合液的体积为100 mL,Y溶液的物质的量浓度为a mol·L-1,则X溶液的物质的量浓度为 mol·L-1(含a代数式表示)。
查看习题详情和答案>>
混合物A由碳酸钠和碳酸氢钠组成.现有两包质量相等的混合物A:
(1)若向其中一包加入100 mL 3 mol/L的Ba(OH)2溶液(过量),使HCO3-、CO32-全部变为沉淀,过滤后,再向滤液中加入200 mL 2 mol/L的稀盐酸,溶液恰好呈中性.
①写出下列反应的离子方程式
碳酸氢钠与过量氢氧化钡的反应:________;
②混合物A中NaHCO3的质量为________g.
(2)若向另一包中先加50 mL 8 mol/L的HCl溶液,使HCO3-、CO32-全部变为CO2后,再加50 mL 2 mol/L的Ba(OH)2溶液,混合后的溶液pH=14(混合后溶液体积变化忽略不计、在常温下).混合物A中Na2CO3的质量为________g.
用电位测定法以0.1 mol?L-1 AgNO3溶液滴定含有Na2C2O4和NaI的混合物样品,以银电极为指示电极,加入10 mL AgNO3溶液后,达第一等当点;加入20 mL AgNO3溶液后。达第二等当点。然后,再取一份与第一份完全相同的混合物样品,向其中加入8×10-2 mol?L-1 KMnO4溶液10 mL,,0.66 mol?L-1 H2SO410 mL,稀释至100 mL,插入铂电极和饱和甘汞电极(SCE)
(1)计算在两个等当点处银电极的电极电位;
(2)计算由铂电极和饱和甘汞电极(SCE)组成的电池的电动势。
(已知:Ag2C2O4、AgI的溶度积Ksp分别为10-11、10-16;电极的标准电位:E![]() = 0.799 V E
= 0.799 V E![]() = 1.51 V ESCE = 0.248 V)
= 1.51 V ESCE = 0.248 V)
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
⑴ 第①步Cu与酸反应的离子方程式为___________________________________;
⑵ 第②步加H2O2的作用是把Fe2+氧化为Fe3+,使用H2O2的优点是___________________;
⑶ 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是____________________________(填仪器名称和操作方法)。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:

上述三种方案中,______方案不可行,从原子利用率角度考虑,_______方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol· L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+
在往滴定管中装入标准液之前,滴定管应该先经过 ,再用水清洗干净,
然后再 ,方可装入标准液。排除酸式滴定管尖嘴处气泡的方法是 。在滴定时, 手操作滴定管活塞。
(6)写出计算CuSO4·5H2O质量分数的表达式(要求带单位)ω= _____________ ;
(7)下列操作会导致CuSO4·5H2O含量的测定结果偏高的有_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡 ks5u
c.未除净可与EDTA反应的干扰离子
d.读取滴定管中待测液的初始体积时仰视
查看习题详情和答案>>