网址:http://m.1010jiajiao.com/timu3_id_361270[举报]
(13分)材料1.某温度时,在2L密闭容器中有X、Y、Z三种气态物质。实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ。
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.60 | 0.20 | 0.80 |
| 14 | 0.60 | 0.20 | 0.80 |
(2)该温度下反应的平衡常数K= ?。

(3)若该反应的逆反应速率与时间的关系如上图所示,则:
① t2~t3时平衡向 (填“正”或“逆”)反应方向移动。
②t4时被改变的外界条件是 (选择一个正确选项)
| A.升温 | B.降温 | C.降压 | D.移去部分反应物 E.加入负催化剂 |
| 实验 编号 | 温度/K | 盐酸浓度 /mol·L-1 | 醋酸浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.20 | | a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。 |
| ② | 308 | 0.20 | | |
| ③ | 298 | 0.40 | | |
| ④ | | 0.20 | 0.20 | |
| ⑤ | | | |
(5)上表实验①中,镁条消失的时间为20s。实验过程中,镁条剩余质量与时间关系图如图。

Ⅰ. 假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是 。
Ⅱ.若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解)。 查看习题详情和答案>>
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.60 | 0.20 | 0.80 |
| 14 | 0.60 | 0.20 | 0.80 |
(2)该温度下反应的平衡常数K= ?。

(3)若该反应的逆反应速率与时间的关系如上图所示,则:
① t2~t3时平衡向 (填“正”或“逆”)反应方向移动。
②t4时被改变的外界条件是 (选择一个正确选项)
| A.升温 | B.降温 | C.降压 | D.移去部分反应物 E.加入负催化剂 |
| 实验 编号 | 温度/K | 盐酸浓度 /mol·L-1 | 醋酸浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.20 | | a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。 |
| ② | 308 | 0.20 | | |
| ③ | 298 | 0.40 | | |
| ④ | | 0.20 | 0.20 | |
| ⑤ | | | |
(5)上表实验①中,镁条消失的时间为20s。实验过程中,镁条剩余质量与时间关系图如图。
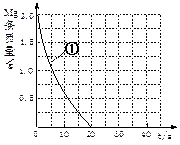
Ⅰ. 假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是 。
Ⅱ.若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解)。
(2)从合成塔分离出甲醇的原理与下列_________操作的原理比较相符(填字母)
A.过滤 B.分液 C.蒸馏 D.结晶
工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施。“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括_______________ 。
(3)一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。
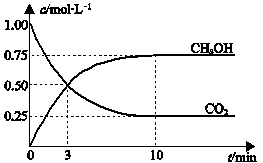
A.升高温度能使
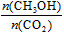 增大
增大B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol·L-1·min-1
(4) 如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
已知
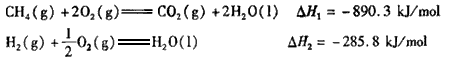
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式____________。
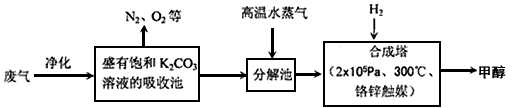
为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇.“绿色自由”构想的部分技术流程如下:
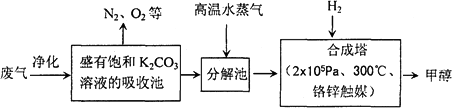
(1)合成塔中反应的化学方程式为________;ΔH<0.该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率.而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了________.
(2)从合成塔分离出甲醇的原理与下列________操作的原理比较相符(填字母)
A.过滤
B.分液
C.蒸馏
D.结晶
工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施.“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括________.
(3)一定条件下
,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是________.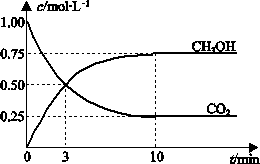
A.升高温度能使![]() 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min
时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率D.
从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-1(4)如将CO2与H2以1∶4的体积比混合,在适当的条件下可制得CH4.
已知CH4(g)+2O2(g)![]() CO2(g)+2H2O(1)ΔH1=-890.3 kJ/mol
CO2(g)+2H2O(1)ΔH1=-890.3 kJ/mol
H2(g)+![]() O2(g)
O2(g)![]() H2O(l)ΔH2=-285.8 kJ/mol
H2O(l)ΔH2=-285.8 kJ/mol
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式________.
(14分) 为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下:
(1)合成塔中反应的化学方程式为 ;△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了 。
(2)从合成塔分离出甲醇的原理与下列 操作的原理比较相符(填字母)
A.过滤 B.分液 C.蒸馏 D.结晶
工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施。“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括 。
(3)一定条件下,向体积为1 L的密闭容器中充入1 molCO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是 。
A.升高温度能使增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1
(4) 如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
巳知
写出C02(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式
___________ _____。
查看习题详情和答案>>