摘要:用已知浓度为98%的密度为1.84g/mL的浓硫酸.来配制质量分数为49%的硫酸溶液.试确定取用的98%的浓硫酸与水的体积比例: A 大于1 B等于1 C 小于1 D无法确定
网址:http://m.1010jiajiao.com/timu3_id_360871[举报]
利用电化学法生产硫酸,可使绝大多数硫磺直接转化为SO3,在生产硫酸的同时还能化学发电,请回答下列问题:
(1)已知下列反应的能量变化示意图
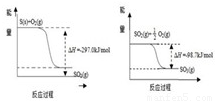
①1molS(g)与O2(g)完全反应生成SO2(g),反应的△H -297.0kJ/mol(填“>”或“<”)
②写出S(s)与O2(g)反应生成SO3(g)的热化学方程式 .
(2)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子.
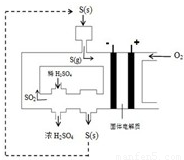
①正极反应式为 .
②S(g)在负极发生的反应为 、 .
③用化学方程式解释装置中稀硫酸转变为浓硫酸的原因 .
④每生产1L浓度为98%,密度为1.84g/mL的浓硫酸,理论上可向用电器提供 mol电子,将消耗 mol氧气.
⑤已知S(g)在负极发生的反应为可逆反应,请分析为提高硫磺蒸气的转化率,该工艺采取的措施有 . . 查看习题详情和答案>>
(1)已知下列反应的能量变化示意图

①1molS(g)与O2(g)完全反应生成SO2(g),反应的△H -297.0kJ/mol(填“>”或“<”)
②写出S(s)与O2(g)反应生成SO3(g)的热化学方程式 .
(2)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子.

①正极反应式为 .
②S(g)在负极发生的反应为 、 .
③用化学方程式解释装置中稀硫酸转变为浓硫酸的原因 .
④每生产1L浓度为98%,密度为1.84g/mL的浓硫酸,理论上可向用电器提供 mol电子,将消耗 mol氧气.
⑤已知S(g)在负极发生的反应为可逆反应,请分析为提高硫磺蒸气的转化率,该工艺采取的措施有 . . 查看习题详情和答案>>
(2013?丰台区二模)利用电化学法生产硫酸,可使绝大多数硫磺直接转化为SO3,在生产硫酸的同时还能化学发电,请回答下列问题:
(1)已知下列反应的能量变化示意图
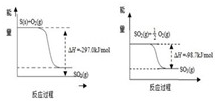
①1molS(g)与O2(g)完全反应生成SO2(g),反应的△H
②写出S(s)与O2(g)反应生成SO3(g)的热化学方程式
(2)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子.
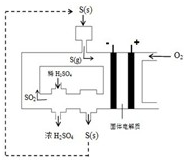
①正极反应式为
②S(g)在负极发生的反应为
③用化学方程式解释装置中稀硫酸转变为浓硫酸的原因
④每生产1L浓度为98%,密度为1.84g/mL的浓硫酸,理论上可向用电器提供
⑤已知S(g)在负极发生的反应为可逆反应,请分析为提高硫磺蒸气的转化率,该工艺采取的措施有
查看习题详情和答案>>
(1)已知下列反应的能量变化示意图

①1molS(g)与O2(g)完全反应生成SO2(g),反应的△H
<
<
-297.0kJ/mol(填“>”或“<”)②写出S(s)与O2(g)反应生成SO3(g)的热化学方程式
S(s)+
O2(g)=SO3(g)△H=-395.3kJ/mol
| 3 |
| 2 |
S(s)+
O2(g)=SO3(g)△H=-395.3kJ/mol
.| 3 |
| 2 |
(2)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子.

①正极反应式为
O2+4e-=2O2-
O2+4e-=2O2-
.②S(g)在负极发生的反应为
S-4e-+2O2-=SO2
S-4e-+2O2-=SO2
、S-6e-+3O2-=SO3
S-6e-+3O2-=SO3
.③用化学方程式解释装置中稀硫酸转变为浓硫酸的原因
SO3+H2O=H2SO4
SO3+H2O=H2SO4
.④每生产1L浓度为98%,密度为1.84g/mL的浓硫酸,理论上可向用电器提供
110.4
110.4
mol电子,将消耗27.6
27.6
mol氧气.⑤已知S(g)在负极发生的反应为可逆反应,请分析为提高硫磺蒸气的转化率,该工艺采取的措施有
硫磺(二氧化硫)循环使用
硫磺(二氧化硫)循环使用
.用稀硫酸吸收三氧化硫
用稀硫酸吸收三氧化硫
. 实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:C2H5-OH+HBr
| 浓H2SO4 |
| △ |
已知反应物的用量为:0.30mol NaBr(s);0.25mol C2H5OH(密度为0.80g?cm-3);36mL浓H2SO4(质量分数为98%,密度为1.84g?mL-1);25mL水.试回答下列问题.
(1)该实验应选择图中的a装置还是b装置?
a
a
.(2)反应装置中的烧瓶应选择下列哪种规格最合适
C
C
A.50mL B.100mL C.150mL D.250mL
(3)冷凝管中的冷凝水的流向应是
B
B
A.A进B出 B.B进A出 C.从A进或B进均可
(4)可能发生的副反应为:
2C2H5OH
C2H5OC2H5+H2O
| 浓硫酸 |
| 140℃ |
2C2H5OH
C2H5OC2H5+H2O
、| 浓硫酸 |
| 140℃ |
2HBr+H2SO4(浓)
Br2+SO2↑+2H2O
| ||
2HBr+H2SO4(浓)
Br2+SO2↑+2H2O
、
| ||
C2H5OH+2H2SO4(浓)
2C+2SO2↑+5H2O
| △ |
C2H5OH+2H2SO4(浓)
2C+2SO2↑+5H2O
(至少写出3个方程式).| △ |
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是
将粗溴乙烷和稀NaOH(aq)的混合物放在分液漏斗中用力振荡,并不断放气,至油层无色,分液可得纯溴乙烷
将粗溴乙烷和稀NaOH(aq)的混合物放在分液漏斗中用力振荡,并不断放气,至油层无色,分液可得纯溴乙烷
.实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5-OH+HBr
C2H5Br+H2O
已知反应物的用量为:0.30mol NaBr(s);0.25mol C2H5OH(密度为0.80g-cm-3);36mL浓H2SO4(质量分数为98%,密度为1.84g-mL-1);25mL水.试回答下列问题.
(1)该实验应选择图中的a装置还是b装置?______.
(2)反应装置中的烧瓶应选择下列哪种规格最合适______
A.50mL B.100mL C.150mL D.250mL
(3)冷凝管中的冷凝水的流向应是______
A.A进B出 B.B进A出 C.从A进或B进均可
(4)可能发生的副反应为:______、______、______(至少写出3个方程式).
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是______.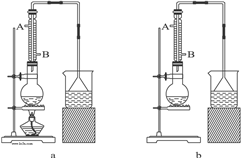
查看习题详情和答案>>
C2H5-OH+HBr
| 浓H2SO4 |
| △ |
已知反应物的用量为:0.30mol NaBr(s);0.25mol C2H5OH(密度为0.80g-cm-3);36mL浓H2SO4(质量分数为98%,密度为1.84g-mL-1);25mL水.试回答下列问题.
(1)该实验应选择图中的a装置还是b装置?______.
(2)反应装置中的烧瓶应选择下列哪种规格最合适______
A.50mL B.100mL C.150mL D.250mL
(3)冷凝管中的冷凝水的流向应是______
A.A进B出 B.B进A出 C.从A进或B进均可
(4)可能发生的副反应为:______、______、______(至少写出3个方程式).
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是______.

Ⅰ 某同学为了验证氢气还原氧化铜的反应产物,设计了如下图所示的实验装置。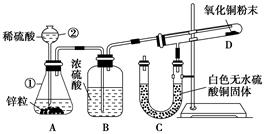
(1)写出编号仪器的名称:①____ ____ ②_____ ___。
(2)浓硫酸的作用是____________________________________。
(3)本实验需要加热的装置为________(填字母编号)。
(4)写出装置C、D中可观察到的现象:C________,D________。
(5)D中反应每生成1mol水分子,转移的电子数为________个。
Ⅱ 实验时他需要1.0mol/L的硫酸溶液250mL。根据溶液的配制回答下列问题。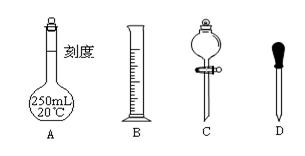
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 。
(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转几次,摇匀。
(3)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL,如果实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好。