题目内容
(2013?丰台区二模)利用电化学法生产硫酸,可使绝大多数硫磺直接转化为SO3,在生产硫酸的同时还能化学发电,请回答下列问题:
(1)已知下列反应的能量变化示意图
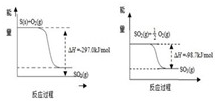
①1molS(g)与O2(g)完全反应生成SO2(g),反应的△H
②写出S(s)与O2(g)反应生成SO3(g)的热化学方程式
(2)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子.
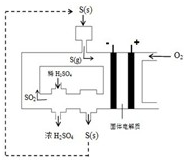
①正极反应式为
②S(g)在负极发生的反应为
③用化学方程式解释装置中稀硫酸转变为浓硫酸的原因
④每生产1L浓度为98%,密度为1.84g/mL的浓硫酸,理论上可向用电器提供
⑤已知S(g)在负极发生的反应为可逆反应,请分析为提高硫磺蒸气的转化率,该工艺采取的措施有
(1)已知下列反应的能量变化示意图

①1molS(g)与O2(g)完全反应生成SO2(g),反应的△H
<
<
-297.0kJ/mol(填“>”或“<”)②写出S(s)与O2(g)反应生成SO3(g)的热化学方程式
S(s)+
O2(g)=SO3(g)△H=-395.3kJ/mol
| 3 |
| 2 |
S(s)+
O2(g)=SO3(g)△H=-395.3kJ/mol
.| 3 |
| 2 |
(2)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子.

①正极反应式为
O2+4e-=2O2-
O2+4e-=2O2-
.②S(g)在负极发生的反应为
S-4e-+2O2-=SO2
S-4e-+2O2-=SO2
、S-6e-+3O2-=SO3
S-6e-+3O2-=SO3
.③用化学方程式解释装置中稀硫酸转变为浓硫酸的原因
SO3+H2O=H2SO4
SO3+H2O=H2SO4
.④每生产1L浓度为98%,密度为1.84g/mL的浓硫酸,理论上可向用电器提供
110.4
110.4
mol电子,将消耗27.6
27.6
mol氧气.⑤已知S(g)在负极发生的反应为可逆反应,请分析为提高硫磺蒸气的转化率,该工艺采取的措施有
硫磺(二氧化硫)循环使用
硫磺(二氧化硫)循环使用
.用稀硫酸吸收三氧化硫
用稀硫酸吸收三氧化硫
.分析:①由图可知,1molS(s)与O2(g)完全反应生成SO2(g),△H=-297.0kJ/mol,S(g)=S(s)为放热过程,则1molS(g)与O2(g)完全反应生成SO2(g),放出的热量更多;
(2)S(s)+O2(g)=SO2(g)△H=-297.0kJ/mol,SO2(g)+
O2(g)=SO3(g)△H=-98.3kJ/mol,结合盖斯定律分析;
(3)电池反应中氧元素的化合价降低,S元素的化合价升高,1L浓度为98%,密度为1.84g/mL的浓硫酸,n(H2SO4)=
=18.4mol,结合S~6e-~1.5O2~H2SO4来计算,并结合平衡移动分析提高转化率.
(2)S(s)+O2(g)=SO2(g)△H=-297.0kJ/mol,SO2(g)+
| 1 |
| 2 |
(3)电池反应中氧元素的化合价降低,S元素的化合价升高,1L浓度为98%,密度为1.84g/mL的浓硫酸,n(H2SO4)=
| 1000×1.84×98% |
| 98 |
解答:解:①由图可知,1molS(s)与O2(g)完全反应生成SO2(g),△H=-297.0kJ/mol,S(g)=S(s)为放热过程,则1molS(g)与O2(g)完全反应生成SO2(g),放出的热量更多,所以反应的△H<-297.0kJ/mol,故答案为:<;
(2)S(s)+O2(g)=SO2(g)△H=-297.0kJ/mol,SO2(g)+
O2(g)=SO3(g)△H=-98.3kJ/mol,
由盖斯定律可知,两个反应相加可得S(s)+
O2(g)=SO3(g)△H=-297.0kJ/mol+(-98.3kJ/mol)=-395.3kJ/mol,
故答案为:S(s)+
O2(g)=SO3(g)△H=-395.3kJ/mol;
(3)电池反应中氧元素的化合价降低,S元素的化合价升高,则S为负极,通氧气一端为正极,
①正极反应式为O2+4e-=2O2-,故答案为:O2+4e-=2O2-;
②负极反应为S-4e-+2O2-=SO2、S-6e-+3O2-=SO3,故答案为:S-4e-+2O2-=SO2;S-6e-+3O2-=SO3;
③1L浓度为98%,密度为1.84g/mL的浓硫酸,n(H2SO4)=
=18.4mol,
由S~6e-~1.5O2~H2SO4可知,提供电子为18.4mol×6=110.4mol,消耗氧气为18.4mol×1.5=27.6mol,故答案为:110.4;27.6;并
④若提高转化率,则平衡正向移动,所以可采取硫磺(二氧化硫)循环使用或用稀硫酸吸收三氧化硫,故答案为:硫磺(二氧化硫)循环使用;用稀硫酸吸收三氧化硫.
(2)S(s)+O2(g)=SO2(g)△H=-297.0kJ/mol,SO2(g)+
| 1 |
| 2 |
由盖斯定律可知,两个反应相加可得S(s)+
| 3 |
| 2 |
故答案为:S(s)+
| 3 |
| 2 |
(3)电池反应中氧元素的化合价降低,S元素的化合价升高,则S为负极,通氧气一端为正极,
①正极反应式为O2+4e-=2O2-,故答案为:O2+4e-=2O2-;
②负极反应为S-4e-+2O2-=SO2、S-6e-+3O2-=SO3,故答案为:S-4e-+2O2-=SO2;S-6e-+3O2-=SO3;
③1L浓度为98%,密度为1.84g/mL的浓硫酸,n(H2SO4)=
| 1000×1.84×98% |
| 98 |
由S~6e-~1.5O2~H2SO4可知,提供电子为18.4mol×6=110.4mol,消耗氧气为18.4mol×1.5=27.6mol,故答案为:110.4;27.6;并
④若提高转化率,则平衡正向移动,所以可采取硫磺(二氧化硫)循环使用或用稀硫酸吸收三氧化硫,故答案为:硫磺(二氧化硫)循环使用;用稀硫酸吸收三氧化硫.
点评:本题考查较为综合,涉及热化学反应方程式、原电池、化学平衡等考试热点,注重高考常考考点的考查,题目难度中等,(3)为解答的易错点.

练习册系列答案
相关题目
