摘要:23.用过量的锌与浓 H2SO4反应.某同学认为除了生成SO2外.还有H2 产生.理由是 , (2) 用过量的铜片与0.2mol浓H2SO4共热足够长时间(只考虑铜与H2SO4反应.忽略其它副反 应).甲认为产生的SO2等于0.1mol.理由是 , 而乙同学认为产生的SO2小于0.1mol.理由是 ; 你认为 同学正确. (3) 工业制取CuSO4不是直接用铜和浓H2SO4反应.而是将Cu和少量Ag的混合物漫在稀H2SO4 中.并不断从容器下部吹入细小的空气泡.这样做的优点是 . ①不产生污染大气的SO2②提高H2SO4的利用率③节省能源④提高铜的利用率
网址:http://m.1010jiajiao.com/timu3_id_360866[举报]
 某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:
某同学设计了如图所示装置(部分夹持装置已略去)进行实验研究.请回答:(1)用上述装置探究影响化学反应速率的因素.
①圆底烧瓶中发生反应的离子方程式是
Zn+2H+=Zn2++H2↑
Zn+2H+=Zn2++H2↑
.②用上述装置进行实验,以生成9.0mL气体为计时终点,结果为t1>t2.
| 序号 | V(H2SO4)/mL | C(H2SO4)/mol?L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 4 | t2 |
在其它条件一定时,化学反应速率随反应物浓度的增大而增大
在其它条件一定时,化学反应速率随反应物浓度的增大而增大
.实验过程中,对量气管的操作是
调整量气管,使其左右管中水面始终持平
调整量气管,使其左右管中水面始终持平
.③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是(填序号)
abc
abc
.A.石墨 b.银 c.铜d.沙粒(二氧化硅)
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀.
①圆底烧瓶中的试剂可选用(填序号)
ac
ac
.a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是
量气管右端液面下降,左端液面上升
量气管右端液面下降,左端液面上升
.科研人员将软锰矿(MnO2含量≥65%,SiO2含量约20%,A12O3含量约4%,其余为水分)和闪锌矿(ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分)同槽酸浸开发出综合利用这两种资源的新工艺,如图所示为工艺流程的一部分.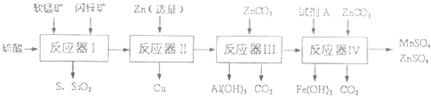
已知:ZnCO3不溶于水,但溶于酸.部分阳离子以氢氧化物形式深沉时溶液的pH见下表:
请回答:
(1)反应器I过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、A12(CO4)3等.试完成反应器I中生成CuSO4的化学方程式(不须配平):CuS+
(2)反应器II中发生反应的离子方程式为
(3)从沉淀溶解平衡的角度分析反应器III中生成A1(OH)3沉淀的原因
(4)反应器中IV中,试剂A可以是下列物质中
(5)欲从反应器IV的滤液中完全沉淀出Zn(OH)2,而不析出Mn(OH)2,则滤液的pH范围为
查看习题详情和答案>>

已知:ZnCO3不溶于水,但溶于酸.部分阳离子以氢氧化物形式深沉时溶液的pH见下表:
| 物质 | Fe(OH)3 | A1(OH)3 | Zn(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 5.4 | 7.6 | 8.3 |
| 完全沉淀pH | 4.4 | 5.2 | 8.0 | 9.6 | 9.8 |
(1)反应器I过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、A12(CO4)3等.试完成反应器I中生成CuSO4的化学方程式(不须配平):CuS+
MnO2
MnO2
+H2SO4→S↓
S↓
+MnSO4
MnSO4
+CuSO4+H2O(2)反应器II中发生反应的离子方程式为
Zn+2Fe3+=2Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+
Zn+2Fe3+=2Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+
.(3)从沉淀溶解平衡的角度分析反应器III中生成A1(OH)3沉淀的原因
ZnCO3与溶液中的H+反应,导致溶液中c(H+)减小,c(OH-)增大,c(Al3+)?c(OH-)>Ksp[Al(OH)3],
ZnCO3与溶液中的H+反应,导致溶液中c(H+)减小,c(OH-)增大,c(Al3+)?c(OH-)>Ksp[Al(OH)3],
.检验ZnCO3是否过量的操作方法是取少许沉淀于试管中,滴加适量的稀硫酸,若有气泡产生,则说明ZnCO3过量;若无气泡产生,则说明ZnCO3不过量
取少许沉淀于试管中,滴加适量的稀硫酸,若有气泡产生,则说明ZnCO3过量;若无气泡产生,则说明ZnCO3不过量
.(4)反应器中IV中,试剂A可以是下列物质中
c
c
(填代号).a.氨水 b.氢氧化钠 c.MnO2 d.稀硫酸(5)欲从反应器IV的滤液中完全沉淀出Zn(OH)2,而不析出Mn(OH)2,则滤液的pH范围为
8.0≤pH<8.3
8.0≤pH<8.3
,要将分离出沉淀后的滤液进行浓缩,需将温度控制在90℃~100℃,可采用的加热方法是水浴加热
水浴加热
.硫酸锌是制备荧光粉的原料之一.工业上用锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4?7H2O的流程如下:

已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7、6.5、9.6.
(1)浸取过程中,为提高浸出效率可采用的措施有
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;②
(3)氧化过程中,H2O2发生反应的离子方程式为
(4)加入适量Ca(OH)2调节溶液pH、促进Fe3+水解,则Fe3+水解反应的平衡常数表达式K=
;Ca(OH)2不能过量的原因是
查看习题详情和答案>>

已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7、6.5、9.6.
(1)浸取过程中,为提高浸出效率可采用的措施有
将矿石粉碎(或提高浸取时的温度,或适当增大酸的浓度等合理答案均可)
将矿石粉碎(或提高浸取时的温度,或适当增大酸的浓度等合理答案均可)
.(任答一条)ZnO与稀硫酸反应的化学方程式为ZnO+H2SO4(稀)═ZnSO4+H2O
ZnO+H2SO4(稀)═ZnSO4+H2O
.(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;②
除去Cu2+
除去Cu2+
.(3)氧化过程中,H2O2发生反应的离子方程式为
H2O2+2Fe2++2H+═2Fe3++2H2O
H2O2+2Fe2++2H+═2Fe3++2H2O
.(4)加入适量Ca(OH)2调节溶液pH、促进Fe3+水解,则Fe3+水解反应的平衡常数表达式K=
| c3(H+) |
| c(Fe3+) |
| c3(H+) |
| c(Fe3+) |
防止生成Zn(OH)2
防止生成Zn(OH)2
.