摘要:12.有下列转化关系: E D B O2 O2 一定条件 A ⑴若C是可用做自来水消毒的气体.D.E是氧化物.D转化为E时增加氧的质量约是D物质总质量的25.8%.则A是 . ⑵若E是酸酐.且为易挥发的晶体.则A是 .D转化为E的条件是 . ⑶若C是水.B是无氧化合物.且是同系物中相对分子质量最小的化合物.E能使紫色石蕊显红色.则A是 .A.B.D.E中易溶于C的是 .
网址:http://m.1010jiajiao.com/timu3_id_360748[举报]
在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙、丙、丁 四个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热量(Q),及平衡时的转化率(X)如下表所示:
(1)下列说法一定正确的是______
a、2Q3=2Q2<Q1<197kJ b、2X3=2X2<X1<100%
c、Q1>Q4 且 X1>X4 d、SO3的质量m:m甲=m丁>2m乙
e、容器内压强p:p甲=p丁>2p乙 f、c(SO2)与c(O2)之比k:k甲=k丙>k乙
h、若乙的体积为2L,则到达平衡时放出的热量小于39.4kJ
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)______(填“增大”或“减小”),O2的浓度______(填“增大”或“减小”)
②假设又向容器中加入一定量的SO3(g),X(SO2)______ (填“增大”或“减小”)
(3)平衡时,乙容器中SO2的体积分数为______%(保留两位有效数字),该反应的平衡常数为______(填具体值和单位,保留两位有效数字)
(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).
①t 2时改变的条件是______;
②若t5时降低压强,试画出t-v图象
③若各阶段对应的平衡常数如图所示
则各平衡常数间的大小关系为______(由大到小排列)
查看习题详情和答案>>
| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2(mol) | O2(mol) | SO3(mol) | N2 | |||
| 甲 | 2 | 1 | Q1 | X1 | ||
| 乙 | 1 | 0.5 | Q2=39.4 | X2 | ||
| 丙 | 1 | 0.5 | 1 | Q3 | X3 | |
| 丁 | 1.8 | 0.9 | 0.2 | Q4 | X4 | |
a、2Q3=2Q2<Q1<197kJ b、2X3=2X2<X1<100%
c、Q1>Q4 且 X1>X4 d、SO3的质量m:m甲=m丁>2m乙
e、容器内压强p:p甲=p丁>2p乙 f、c(SO2)与c(O2)之比k:k甲=k丙>k乙
h、若乙的体积为2L,则到达平衡时放出的热量小于39.4kJ
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)______(填“增大”或“减小”),O2的浓度______(填“增大”或“减小”)
②假设又向容器中加入一定量的SO3(g),X(SO2)______ (填“增大”或“减小”)
(3)平衡时,乙容器中SO2的体积分数为______%(保留两位有效数字),该反应的平衡常数为______(填具体值和单位,保留两位有效数字)
(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).

①t 2时改变的条件是______;
②若t5时降低压强,试画出t-v图象
③若各阶段对应的平衡常数如图所示
| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
查看习题详情和答案>>
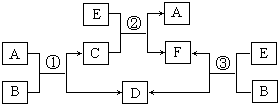 A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.
A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.(1)若反应①②③均为溶液中的置换反应,A、D、E为卤素单质,且通常状况下A为液态非金属单质,B的焰色反应为黄色,则根据反应①.②.③比较相关物质的氧化性由强到弱的顺序为
E>A>D
E>A>D
(用字母A.B.C…表示);反应①的化学方程式为Cl2+2NaI=2NaCl+I2
Cl2+2NaI=2NaCl+I2
.反应②的离子方程式为Cl2+2Br-=2Cl-+Br2
Cl2+2Br-=2Cl-+Br2
.(2)若B是一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D.E的循环,写下列物质的化学式:A
H2O
H2O
ECO2
CO2
FNa2CO3
Na2CO3
,则反应①的化学方程式为2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
.在反应③中若生成1molD,则转移的电子数目为2NA
2NA
.化学反应原理对于工业生产和科研有重要意义
I、下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
| 化学反应 | 平衡常数 | 温度 | |
| 973 K | 1173 K | ||
①Fe(s)+CO2(g) FeO(s)+CO(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) FeO(s)+H2(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
③CO(g) +H2O(g) CO2(g) +H2(g) CO2(g) +H2(g) | K3 | ? | ? |
请回答:
(1)反应①是 (填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有 _____(填写字母序号)。
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(4)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时__________________; t8时__________________。
②若t4时降压, t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
II、(5)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该装置的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应为 。
(6)某空间站能量转化系统的局部如图所示,其中的燃料电池采用KOH溶液作电解液。

如果某段时间内,氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为 mol。 查看习题详情和答案>>
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)已知:2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-196.6 kJ·mol-1
2SO3(g);ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g);ΔH=-113.0 kJ·mol-1
2NO2(g);ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=________kJ·mol-1.
SO3(g)+NO(g)的ΔH=________kJ·mol-1.
(2)一定条件下,将1 mol NO2与2 mol SO2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________.
a.体系压强保持不变
b.混合气体颜色保持不变
c.体系气体密度不变了
d.每消耗1 mol SO3的同时生成1 mol NO2
e.SO2和NO的体积比保持不变
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________;NO2的转化率=________.
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g).
CH3OH(g).
①该反应在40℃和60℃时的平衡常数分别为K1和K2,若K1大于K2,则该反应为________反应.(填“放热”或“吸热”)
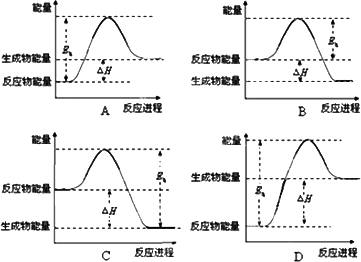
②该反应的焓变为ΔH,活化能为Ea.下列能量关系图合理的是________.
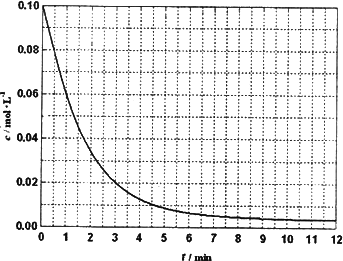
(4)某温度时,根据的H2浓度随时间的变化曲线,请在同一图中绘出CH3OH浓度随时间的变化曲线.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)已知:2SO2(g)+O2(g)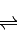 2SO3(g)△H=-196.6kJ?mol-1
2SO3(g)△H=-196.6kJ?mol-1
2NO(g)+O2(g)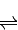 2NO2(g)△H=-113.0kJ?mol-1
2NO2(g)△H=-113.0kJ?mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的△H= kJ?mol-1.
SO3(g)+NO(g)的△H= kJ?mol-1.
(2)一定条件下,将1molNO2与2molSO2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 .
a.体系压强保持不变 b.混合气体颜色保持不变 c.体系气体密度不变了
d.每消耗1mol SO3的同时生成1molNO2 e.SO2和NO的体积比保持不变
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= ;NO2的转化率= .
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)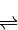 CH3OH(g).
CH3OH(g).
①该反应在40℃和60℃时的平衡常数分别为K1和K2,若K1大于K2,则该反应为 反应.(填“放热”或“吸热”)
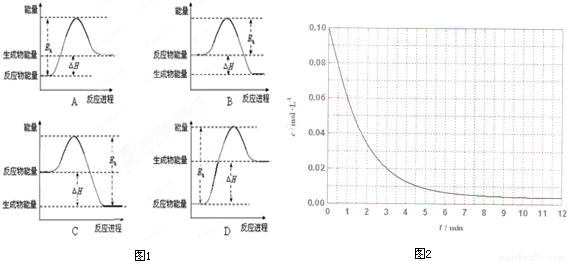
②该反应的焓变为△H,活化能为E,下列能量关系图(图1)合理的是 .
(4)某温度时,根据的H2浓度随时间的变化曲线,请在同一图(图2)中绘出CH2OH浓度随时间的变化曲线.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)已知:2SO2(g)+O2(g)
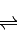 2SO3(g)△H=-196.6kJ?mol-1
2SO3(g)△H=-196.6kJ?mol-12NO(g)+O2(g)
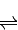 2NO2(g)△H=-113.0kJ?mol-1
2NO2(g)△H=-113.0kJ?mol-1则反应NO2(g)+SO2(g)
 SO3(g)+NO(g)的△H= kJ?mol-1.
SO3(g)+NO(g)的△H= kJ?mol-1.(2)一定条件下,将1molNO2与2molSO2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 .
a.体系压强保持不变 b.混合气体颜色保持不变 c.体系气体密度不变了
d.每消耗1mol SO3的同时生成1molNO2 e.SO2和NO的体积比保持不变
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= ;NO2的转化率= .
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
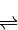 CH3OH(g).
CH3OH(g).①该反应在40℃和60℃时的平衡常数分别为K1和K2,若K1大于K2,则该反应为 反应.(填“放热”或“吸热”)
②该反应的焓变为△H,活化能为E,下列能量关系图(图1)合理的是 .
(4)某温度时,根据的H2浓度随时间的变化曲线,请在同一图(图2)中绘出CH2OH浓度随时间的变化曲线.
 查看习题详情和答案>>
查看习题详情和答案>>