题目内容
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.(1)已知:2SO2(g)+O2(g)
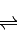 2SO3(g)△H=-196.6kJ?mol-1
2SO3(g)△H=-196.6kJ?mol-12NO(g)+O2(g)
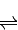 2NO2(g)△H=-113.0kJ?mol-1
2NO2(g)△H=-113.0kJ?mol-1则反应NO2(g)+SO2(g)
 SO3(g)+NO(g)的△H= kJ?mol-1.
SO3(g)+NO(g)的△H= kJ?mol-1.(2)一定条件下,将1molNO2与2molSO2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 .
a.体系压强保持不变 b.混合气体颜色保持不变 c.体系气体密度不变了
d.每消耗1mol SO3的同时生成1molNO2 e.SO2和NO的体积比保持不变
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= ;NO2的转化率= .
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
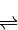 CH3OH(g).
CH3OH(g).①该反应在40℃和60℃时的平衡常数分别为K1和K2,若K1大于K2,则该反应为 反应.(填“放热”或“吸热”)
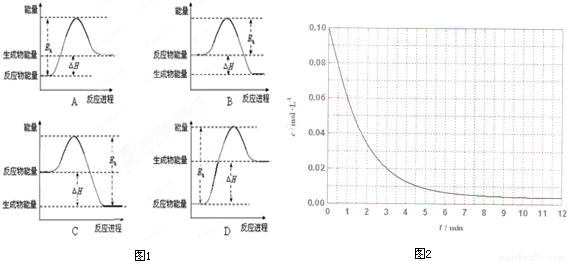
②该反应的焓变为△H,活化能为E,下列能量关系图(图1)合理的是 .
(4)某温度时,根据的H2浓度随时间的变化曲线,请在同一图(图2)中绘出CH2OH浓度随时间的变化曲线.
【答案】分析:(1)依据热化学方程式和盖斯定律计算得到;
(2)平衡标志是正逆反应速率相同,各成分难度保持不变分析选项;依据平衡常数和转化率概念分析计算得到;
(3)①依据平衡常数随温度变化,平衡常数越大,平衡正向进行,温度越高平衡向吸热反应方向进行;
②分析判断反应是放热反应,反应物能量高于生成物,焓变是反应物和生成物之间的能量差值与变化过程无关;
(4)某温度时,根据H2浓度随时间的变化曲线,氢气浓度减小到平衡不变,甲醇浓度增大到平衡不变,依据物质的量的变化绘出CH2OH浓度随时间的变化曲线.
解答:解:(1)①2SO2(g)+O2(g)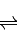 2SO3(g)△H=-196.6kJ?mol-1
2SO3(g)△H=-196.6kJ?mol-1
②2NO(g)+O2(g)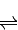 2NO2(g)△H=-113.0kJ?mol-1
2NO2(g)△H=-113.0kJ?mol-1
依据盖斯定律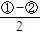 得到热化学方程式为:NO2(g)+SO2(g)
得到热化学方程式为:NO2(g)+SO2(g)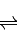 SO3(g)+NO(g)△H=-41.8KJ/mol;
SO3(g)+NO(g)△H=-41.8KJ/mol;
故答案为:-41.8;
(2)a.反应前后气体体积不变,反应过程中体系压强始终保持不变,不能证明反应达到平衡,故a错误;
b.平衡体系中二氧化氮气体是红棕色气体,混合气体颜色保持不变,说明二氧化氮浓度不变,证明反应达到平衡,故b正确;
c.反应前后气体质量不变,体积不变,反应过程中体系的气体密度不变,所以体系气体密度不变不能证明反应达到平衡,故c错误;
d.每消耗1mol SO3的同时生成1molNO2.说明反应逆向进行,不能证明反应达到平衡,故d错误;
e.SO3和NO的体积之比保持不变,在反应过程中始终是1:1,不能说明反应达到平衡,故e错误;
故选b.
一定条件下,将1molNO2与2molSO2置于密闭容器中发生上述反应,NO2(g)+SO2(g)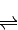 SO3(g)+NO(g)△H=-41.8KJ/mol;测得上述反应平衡时NO2与SO2体积比为1:6,依据化学平衡三段式列式计算,设二氧化氮消耗物质的量为x;
SO3(g)+NO(g)△H=-41.8KJ/mol;测得上述反应平衡时NO2与SO2体积比为1:6,依据化学平衡三段式列式计算,设二氧化氮消耗物质的量为x;
NO2(g)+SO2(g)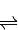 SO3(g)+NO(g)
SO3(g)+NO(g)
起始量(mol) 1 2 0 0
变化量(mol) x x x x
平衡量(mol)1-x 2-x x x
(1-x):(2-x)=1:6
x=0.8mol,设容器体积为1L,平衡浓度c(NO2)=0.2mol/L,c(SO2)=1.2mol/L,c(SO)=0.8mol/L,c(NO)=0.8mol/L;
则平衡常数K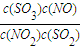 =
=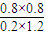 =2.7;
=2.7;
二氧化氮的转化率=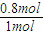 ×100%=80%
×100%=80%
故答案为:b;2.7;80%;
(3)反应方程式为CO(g)+2H2(g)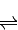 CH3OH(g)
CH3OH(g)
①该反应在40℃和60℃时的平衡常数分别为K1和K2,若K1大于K2,说明温度升高平衡常数减小,平衡逆向进行,正反应是放热反应;
故答案为:放热;
②反应是放热反应,反应物能量高于生成物,焓变是反应物和生成物之间的能量差值;
A、反应物能量低于生成物反应是吸热反应,故A错误;
B、反应物能量高于生成物是放热反应,焓变符合,活化能是正反应的活化能,故B正确;
C、反应物能量高于生成物是放热反应,焓变符合,活化能不是正反应的活化能,故C错误;
D、反应物能量低于生成物反应是吸热反应,故D错误;
故答案为:B;
(4)某温度时,根据图象中的H2浓度随时间的变化曲线,氢气浓度减小到平衡不变,甲醇浓度增大到平衡不变,依据氢气的浓度和化学方程式计算甲醇浓度的增加描点画出图象,(0.01,0.02)(0.02,0.04)(0.03,0.06),(0.04,0.08)绘出CH2OH浓度随时间的变化曲线为: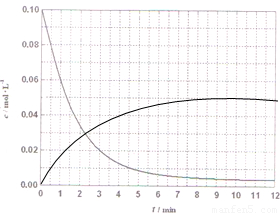 ;故答案为:
;故答案为: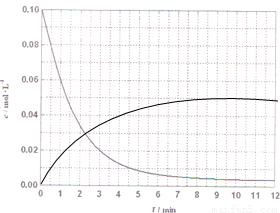 .
.
点评:本题考查了热化学方程式和盖斯定律计算应用,化学平衡影响因素的分析判断,化学平衡的计算应用,图象分析绘制,题目难度中等.
(2)平衡标志是正逆反应速率相同,各成分难度保持不变分析选项;依据平衡常数和转化率概念分析计算得到;
(3)①依据平衡常数随温度变化,平衡常数越大,平衡正向进行,温度越高平衡向吸热反应方向进行;
②分析判断反应是放热反应,反应物能量高于生成物,焓变是反应物和生成物之间的能量差值与变化过程无关;
(4)某温度时,根据H2浓度随时间的变化曲线,氢气浓度减小到平衡不变,甲醇浓度增大到平衡不变,依据物质的量的变化绘出CH2OH浓度随时间的变化曲线.
解答:解:(1)①2SO2(g)+O2(g)
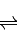 2SO3(g)△H=-196.6kJ?mol-1
2SO3(g)△H=-196.6kJ?mol-1②2NO(g)+O2(g)
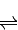 2NO2(g)△H=-113.0kJ?mol-1
2NO2(g)△H=-113.0kJ?mol-1依据盖斯定律
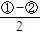 得到热化学方程式为:NO2(g)+SO2(g)
得到热化学方程式为:NO2(g)+SO2(g)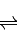 SO3(g)+NO(g)△H=-41.8KJ/mol;
SO3(g)+NO(g)△H=-41.8KJ/mol;故答案为:-41.8;
(2)a.反应前后气体体积不变,反应过程中体系压强始终保持不变,不能证明反应达到平衡,故a错误;
b.平衡体系中二氧化氮气体是红棕色气体,混合气体颜色保持不变,说明二氧化氮浓度不变,证明反应达到平衡,故b正确;
c.反应前后气体质量不变,体积不变,反应过程中体系的气体密度不变,所以体系气体密度不变不能证明反应达到平衡,故c错误;
d.每消耗1mol SO3的同时生成1molNO2.说明反应逆向进行,不能证明反应达到平衡,故d错误;
e.SO3和NO的体积之比保持不变,在反应过程中始终是1:1,不能说明反应达到平衡,故e错误;
故选b.
一定条件下,将1molNO2与2molSO2置于密闭容器中发生上述反应,NO2(g)+SO2(g)
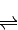 SO3(g)+NO(g)△H=-41.8KJ/mol;测得上述反应平衡时NO2与SO2体积比为1:6,依据化学平衡三段式列式计算,设二氧化氮消耗物质的量为x;
SO3(g)+NO(g)△H=-41.8KJ/mol;测得上述反应平衡时NO2与SO2体积比为1:6,依据化学平衡三段式列式计算,设二氧化氮消耗物质的量为x;NO2(g)+SO2(g)
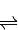 SO3(g)+NO(g)
SO3(g)+NO(g) 起始量(mol) 1 2 0 0
变化量(mol) x x x x
平衡量(mol)1-x 2-x x x
(1-x):(2-x)=1:6
x=0.8mol,设容器体积为1L,平衡浓度c(NO2)=0.2mol/L,c(SO2)=1.2mol/L,c(SO)=0.8mol/L,c(NO)=0.8mol/L;
则平衡常数K
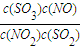 =
=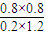 =2.7;
=2.7;二氧化氮的转化率=
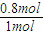 ×100%=80%
×100%=80%故答案为:b;2.7;80%;
(3)反应方程式为CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)①该反应在40℃和60℃时的平衡常数分别为K1和K2,若K1大于K2,说明温度升高平衡常数减小,平衡逆向进行,正反应是放热反应;
故答案为:放热;
②反应是放热反应,反应物能量高于生成物,焓变是反应物和生成物之间的能量差值;
A、反应物能量低于生成物反应是吸热反应,故A错误;
B、反应物能量高于生成物是放热反应,焓变符合,活化能是正反应的活化能,故B正确;
C、反应物能量高于生成物是放热反应,焓变符合,活化能不是正反应的活化能,故C错误;
D、反应物能量低于生成物反应是吸热反应,故D错误;
故答案为:B;
(4)某温度时,根据图象中的H2浓度随时间的变化曲线,氢气浓度减小到平衡不变,甲醇浓度增大到平衡不变,依据氢气的浓度和化学方程式计算甲醇浓度的增加描点画出图象,(0.01,0.02)(0.02,0.04)(0.03,0.06),(0.04,0.08)绘出CH2OH浓度随时间的变化曲线为:
 ;故答案为:
;故答案为: .
.点评:本题考查了热化学方程式和盖斯定律计算应用,化学平衡影响因素的分析判断,化学平衡的计算应用,图象分析绘制,题目难度中等.

练习册系列答案
相关题目
 (2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
(2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.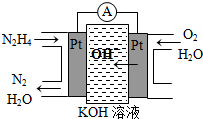 Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.