网址:http://m.1010jiajiao.com/timu3_id_36065[举报]
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体.C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是:
| ||
| ||
a.BaCl2溶液 b.KMnO4溶液 c.品红溶液 d.酸化的Ba(NO3)2溶液
向500mL2mol/L的NaOH溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的化学方程式是
(2)若A为红色金属单质,与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成经棕色.若被还原的B物质的量为2mol时,产生C气体的体积是
(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一.C发生水解反应的离子方程式是
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体.检验A中阴离子的方法是
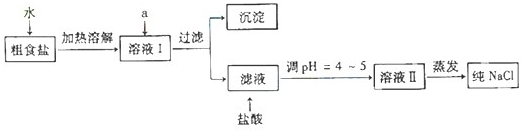
(1)粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为
②过滤之前,怎样检验SO42-已除去:
③过滤所需要的玻璃仪器有
④若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
(2)用提纯的NaCl配制250mL 2.00mol?L-1NaCl溶液.
①所用仪器除药匙及上面过滤涉及到的外,还有
②计算后,需称出NaOH质量为
③下列操作的正确顺序是(用字母表示)
A.摇匀 B.称量 C.洗涤 D.定容 E.溶解 F.移液 G.装瓶
④下列操作对所得溶液浓度有何影响,在横线上填写“偏高”“偏低”或“无影响”.
A 定容时仰视容量瓶刻度线:
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请把导管补充完整。(在原图中画即可)
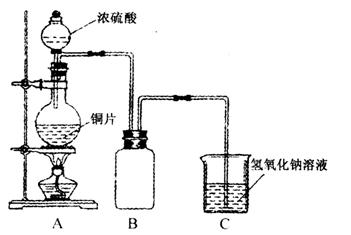
(2)实验中他们取6.4 g铜片和12 mL18 mol·1-1浓硫酸放在圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:_________________________________________。
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是:____________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:_________________(填写字母编号)。
A.铁粉 B.BaCl2溶液
C.银粉 D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是______________________(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量的用稀硫酸酸化的KMnO4溶液,再加入足量的BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况下)
D.将装置A产生的气体缓缓通入足量的氢氧化钡溶液中,反应完全后,过滤、洗涤、干燥,称最沉淀
②乙学生没计的方案是:向反应后的溶液中加蒸馏水稀释至1000 mL,取20 mL于锥形瓶中,滴入2—3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的pH约为5),通过测出消耗NaOH溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为乙学生没计的实验方案能否求得余酸的物质的量浓度_______(填“能”或“否”),其理由是_______。
(4)请再设计一个可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)________________________________________________________。
查看习题详情和答案>>