网址:http://m.1010jiajiao.com/timu3_id_360496[举报]
 Cl2是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.
Cl2是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.Ⅰ:如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
(1)写出A中发生的离子反应方程式:
| ||
| ||
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
①该反应中的氧化剂是
②简要说明K2FeO4作为水处理剂时所起的作用
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O.写出并配平湿法制高铁酸钾的离子反应方程式:
 Cl2是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.
Cl2是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.
Ⅰ:如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
(1)写出A中发生的离子反应方程式:______.
(2)装置B中饱和食盐水的作用是______;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入______.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
①该反应中的氧化剂是______,还原剂是______,每生成1mol Na2FeO4转移______个电子.
②简要说明K2FeO4作为水处理剂时所起的作用______,
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O.写出并配平湿法制高铁酸钾的离子反应方程式:______. 查看习题详情和答案>>
C12是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
Ⅰ:下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)写出A中发生的离子反应方程式: 。
(2)装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 。
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
II:(1)干法制备高铁酸钾的主要反应为:
2FeSO4 + 6Na2O2= 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
①该反应中的氧化剂是 ,还原剂是 ,每生成l molNa2FeO4转移 个电子。
②简要说明K2FeO4作为水处理剂时所起的作用 ,
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式: 。
查看习题详情和答案>>(1)黄铁矿(FeS2,其中S为-1价)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2
| ||
(2)与明矾相似,硫酸铁也可用作净水剂.某自来水厂用氯气和绿矾
 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为Fe3++3H2O?Fe(OH)3(胶体)+3H+
Fe3++3H2O?Fe(OH)3(胶体)+3H+
(3)①钢铁的电化腐蚀简单示意图如右,将该图稍作修改 即可成为钢铁电化学防护的简单示意图,请在右图虚线框内作出修改,并用箭头标出电子流动方向.
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式
(4)高铁酸钾(K2FeO4)可用作净水剂,也可用于制造高铁电池.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为
3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH该电池放电时正极反应式为
用该电池电解100mL 1mol?L-1的AgNO3溶液,当电路中通过0.1mol 电子时,被电解
 溶液的pH为
溶液的pH为(5)氧化亚铜是一种半导体材料,常用作制造整流器的材料,还可以用于光照条件下水分解的催化剂和农作物的杀菌剂.
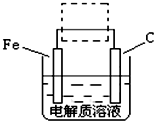
用右图装置可制得氧化亚铜,试写出阳极的电极反应式

(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol B转移5mol 电子,则B与浓盐酸反应的化学方程式为
(2)将F从混合物中分离出来的实验操作步骤为
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式;
| ||
| ||
(4)固体C与FeCl3溶液按物质的量为2:1反应的离子方程式
将Fe(OH)3和NaOH与NaClO混合作用后,是制得緑色水处理剂(Na2FeO4)的一种方法,请完成下列方程式: