摘要:8.⑴CS2 + Na2S = Na2CS3 ⑵P2S5 + K2S = 2KPS3 ⑶Na2S2 + 2HCl = 2NaCl + S↓+H2S↑
网址:http://m.1010jiajiao.com/timu3_id_360494[举报]
(2011?宝鸡模拟)A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素.A是元素周期表所有元素中原子半径最小的;B和C 都只有两个电子层,B中一层电子数是另一层的两倍;C 中两层电子数之和是两层电子数之差的两倍; D中一层电子数是另两层电子数之和;E 核外各层电子数两两相等.
请按要求回答下列问题:
(1)画出E 的离子结构示意图
 ,写出由A 和C 组成的含有非极性键的化合物的电子式
,写出由A 和C 组成的含有非极性键的化合物的电子式
 .
.
(2)由上述元素组成的化合物中属于极性键构成的非极性分子是
(3)由C 与E 形成的化合物高温时与B反应生成两种化合物,请写出该反应的化学方程式
(4)写出上述元素形成的化合物中一种可溶性的正盐与另一种强酸反应的离子方程式:
(5)上述元素形成的化合物中通常能污染空气的是
查看习题详情和答案>>
请按要求回答下列问题:
(1)画出E 的离子结构示意图




(2)由上述元素组成的化合物中属于极性键构成的非极性分子是
CH4、CO2、CS2
CH4、CO2、CS2
. (只要求写出两种,用化学式表示)(3)由C 与E 形成的化合物高温时与B反应生成两种化合物,请写出该反应的化学方程式
CaO+3C
CaC2+CO↑
| ||
CaO+3C
CaC2+CO↑
| ||
(4)写出上述元素形成的化合物中一种可溶性的正盐与另一种强酸反应的离子方程式:
Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓
Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓
(5)上述元素形成的化合物中通常能污染空气的是
CO、SO2、H2S等
CO、SO2、H2S等
(至少写出两种).某一种可污染空气的化合物与强氧化剂单质常温下反应生成两种化合物,该反应的化学方程式为:H2S+O3=SO2+H2O
H2S+O3=SO2+H2O
.理论预测以下物质的物理性质,用>、=、<填空:
(1)CS2的沸点
(2)CsCl的熔点
(3)金属K的硬度
(4)金刚石的硬度
查看习题详情和答案>>
(1)CS2的沸点
>
>
CO2的沸点. (2)CsCl的熔点
<
<
KCl的熔点.(3)金属K的硬度
<
<
金属Ca的硬度 (4)金刚石的硬度
>
>
晶体硅的硬度.X、Y、Z、R、T是原子序数依次增大的短周期主族元素,X、R在周期表中的相对位置如右表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数;Z是地壳中含量最多的金属元素.
(1)X的最高价氧化物的电子式是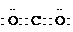
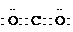 ,元素T在周期表中的位置是
,元素T在周期表中的位置是
(2)Z和T形成的化合物在潮湿的空气中冒白色烟雾,该反应的化学方程式为
(3)Y的最简单气态氢化物甲的水溶液显碱性.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
(4)已知由X和R形成的液态化合物XR2的燃烧热是1075kj/mol,试写出表示其燃烧热的热化学方程式
查看习题详情和答案>>
| X | ||||
| R |
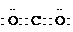
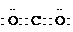
第三周期ⅦA族
第三周期ⅦA族
.(2)Z和T形成的化合物在潮湿的空气中冒白色烟雾,该反应的化学方程式为
AlCl3+3H2O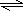 Al(OH)3+3HCl↑
Al(OH)3+3HCl↑
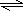 Al(OH)3+3HCl↑
Al(OH)3+3HCl↑AlCl3+3H2O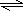 Al(OH)3+3HCl↑
Al(OH)3+3HCl↑
.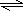 Al(OH)3+3HCl↑
Al(OH)3+3HCl↑(3)Y的最简单气态氢化物甲的水溶液显碱性.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
2NH3?H2O+3H2O2=N2↑+8H2O
2NH3?H2O+3H2O2=N2↑+8H2O
.(4)已知由X和R形成的液态化合物XR2的燃烧热是1075kj/mol,试写出表示其燃烧热的热化学方程式
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol
.铬是人体必需的微量元素,在维持人体健康方面起重要作用.
(1)Cr元素基态原子核外电子排布式为 .
(2)与铬同周期的所有元素的基态原子中,最外层电子数与铬原子相同的元素有 (填元素符号),其中一种金属的+2价阳离子与NH3按1:4个数比形成的配合物离子化学式为 .
(3)CrO2Cl2常温下为深红色液体,能与CS2、CCl4等互溶.
①据此可判断固体CrO2Cl2的晶体类型为 .
②CS2分子中C、S两元素的电负性相对大小为 .
③CCl4分子中C原子的杂化类型为 .
(4)K2Cr2O7与H2O2作用可生成CrO5.CrO5的结构为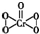 ,其中σ键与π键的个数比为 ;已知H2O2的沸点(152.1℃)比摩尔质量相同的H2S沸点(-60.4℃)高,其原因是 .
,其中σ键与π键的个数比为 ;已知H2O2的沸点(152.1℃)比摩尔质量相同的H2S沸点(-60.4℃)高,其原因是 .
查看习题详情和答案>>
(1)Cr元素基态原子核外电子排布式为
(2)与铬同周期的所有元素的基态原子中,最外层电子数与铬原子相同的元素有
(3)CrO2Cl2常温下为深红色液体,能与CS2、CCl4等互溶.
①据此可判断固体CrO2Cl2的晶体类型为
②CS2分子中C、S两元素的电负性相对大小为
③CCl4分子中C原子的杂化类型为
(4)K2Cr2O7与H2O2作用可生成CrO5.CrO5的结构为
 ,其中σ键与π键的个数比为
,其中σ键与π键的个数比为