摘要:9.(1)PH4I+NaOHPH3↑+NaI+H2O (2)P4受热分解.4PH3+6Fe2(SO4)3====P4+12FeSO4+6H2SO4.还原(3)尾气中含剧毒气体PH3.点燃尾气.以防环境污染(4)使密度大的乙醚蒸气把空气排净.以防止PH3因含P2H4在装置中自燃 (5)D中温度低于乙醚沸点乙醚蒸气在此会液化浮于液面.
网址:http://m.1010jiajiao.com/timu3_id_360218[举报]
现有A、B、C、D四种气体,A、B分别是由元素X和Y形成的单质,A是密度最小的气体,B在通常状况下呈黄绿色.在盛有A、B混合气体的集气瓶外点燃镁条时,可以引起爆炸并生成气体D.将D通入用硝酸酸化的AgNO3 溶液中时,立即出现白色沉淀.将气体C通入澄清的石灰水时,石灰水变浑浊.根据以上事实回答下列问题:
(1)C 的分子式可能是
(2)元素Y的原子在周期表中的位置是
(3)元素X与Na可以形成一种离子化合物NaX,在该化合物中X的化合价为
(4)写出B 与Ca(OH)2澄清溶液反应的离子方程式
查看习题详情和答案>>
(1)C 的分子式可能是
CO2
CO2
,SO2
SO2
.(2)元素Y的原子在周期表中的位置是
第三周期,ⅤⅡA
第三周期,ⅤⅡA
,D的名称为氯化氢
氯化氢
.(3)元素X与Na可以形成一种离子化合物NaX,在该化合物中X的化合价为
-1
-1
,Na+离子半径比Y-半径小
小
(“大”或“小”).(4)写出B 与Ca(OH)2澄清溶液反应的离子方程式
Cl2+2OH-=ClO-+Cl-+H2O
Cl2+2OH-=ClO-+Cl-+H2O
.如图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体.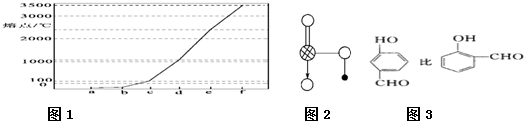
(1)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13)中含
(2)a与b的元素形成的10电子中性分子X的空间构型为
(3)如图2是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个原因
(4)氢键的形成对物质的性质具有一定的影响.沸点
查看习题详情和答案>>

(1)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13)中含
3
3
σ键和2
2
个π键.(2)a与b的元素形成的10电子中性分子X的空间构型为
三角锥形
三角锥形
;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为[Ag(NH3)2]+
[Ag(NH3)2]+
,其中X与Ag+之间以配位
配位
键结合.(3)如图2是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个原因
HNO3中的-OH易与水分子之间形成氢键且HNO3是极性分子,易溶于极性的水中
HNO3中的-OH易与水分子之间形成氢键且HNO3是极性分子,易溶于极性的水中
.(4)氢键的形成对物质的性质具有一定的影响.沸点
高
高
.(填高或低)