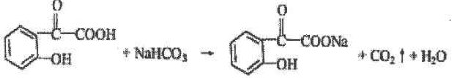
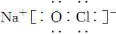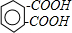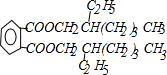题目内容
(2013?红桥区一模)设NA为阿伏加德罗常数,则下列说法正确的是( )
分析:A、电解精炼铜粗铜做阳极失电子发生氧化反应,精铜做阴极得到电子发生还原反应,阳极电子守恒计算分析;
B、依据含有1.5 NA个SO42-离子,同时含有NA个金属阳离子得到盐的化学式应为M2(SO4)3,盐的物质的量为0.5mol;
C、依据n=
计算物质的量,结合过氧化钠是钠离子和过氧根离子构成计算;
D、条件不知无法计算,常温下铁在浓硫酸中发生钝化现象;
B、依据含有1.5 NA个SO42-离子,同时含有NA个金属阳离子得到盐的化学式应为M2(SO4)3,盐的物质的量为0.5mol;
C、依据n=
| m |
| M |
D、条件不知无法计算,常温下铁在浓硫酸中发生钝化现象;
解答:解:A、电解精炼铜粗铜做阳极失电子发生氧化反应,精铜做阴极得到电子发生还原反应,若阴极得到电子数为2 NA,阳极共失电子2 NA,阳极电极反应由Cu-2e-=Cu2+,Fe-2e-=Fe2+,Zn-2e-=Zn2+,Ni-2e-=Ni2+,所以阳极溶解减少的质量不是铜失电子溶解的质量,故A错误;
B、200mL某硫酸盐溶液中含有1.5 NA个SO42-离子,同时含有NA个金属阳离子,盐的化学式应为M2(SO4)3,盐的物质的量为0.5mol;该盐物质的量浓度是2.5 mol/L,故B正确;
C、常温常压下,78g Na2O2固体物质的量为1mol,过氧化钠是钠离子和过氧根离子构成,所含阴、阳离子总数为3 NA,故C错误;
D、常温下铁在浓硫酸中发生钝化现象,一定条件下,足量的Fe粉与浓硫酸反应,转移电子数不一定为2 NA,故D错误;
故选B.
B、200mL某硫酸盐溶液中含有1.5 NA个SO42-离子,同时含有NA个金属阳离子,盐的化学式应为M2(SO4)3,盐的物质的量为0.5mol;该盐物质的量浓度是2.5 mol/L,故B正确;
C、常温常压下,78g Na2O2固体物质的量为1mol,过氧化钠是钠离子和过氧根离子构成,所含阴、阳离子总数为3 NA,故C错误;
D、常温下铁在浓硫酸中发生钝化现象,一定条件下,足量的Fe粉与浓硫酸反应,转移电子数不一定为2 NA,故D错误;
故选B.
点评:本题考查了电解精炼原理的分析应用,溶液中溶质浓度的简单和化学式的判断,过氧化钠构成,常温浓硫酸和铁发生钝化现象是解题关键,题目难度中等.

练习册系列答案
相关题目