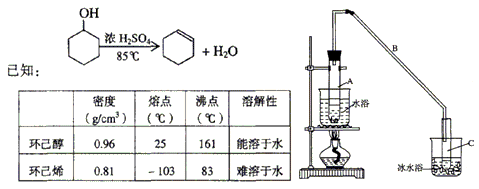
网址:http://m.1010jiajiao.com/timu3_id_360097[举报]
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下: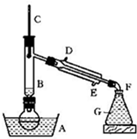
NaBr + H2SO4 → NaHSO4 + HBr
CH3CH2OH + HBr CH3CH2Br + H2O
CH3CH2Br + H2O
某课外小组欲在实验室制备溴乙烷的装置如右图。数据如下表。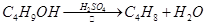
| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g·cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
请回答下列问题。
(1)加入药品之前须做的操作是:_________________,实验进行的途中若发现未加入碎瓷片,其处理的方法是__________________。
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是_____________。温度计的温度应控制在_____________之间。
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是___________,______________,此操作可在___________(填写玻璃仪器名称)中进行,同时进行分离。
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了_______________________。
(5)粗产品中含有的主要有机液体杂质是_____________,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行______________操作。 查看习题详情和答案>>
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
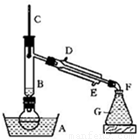
NaBr + H2SO4 → NaHSO4 + HBr
CH3CH2OH + HBr CH3CH2Br
+ H2O
CH3CH2Br
+ H2O
某课外小组欲在实验室制备溴乙烷的装置如右图。数据如下表。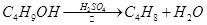
|
物质 数据 |
乙醇 |
溴乙烷 |
1,2-二溴乙烷 |
乙醚 |
浓硫酸 |
|
密度/g·cm-3 |
0.79 |
1.46 |
2.2 |
0.71 |
1.84 |
|
熔点(℃) |
-130 |
-119 |
9 |
-116 |
10 |
|
沸点(℃) |
78.5 |
38.4 |
132 |
34.6 |
338 |
|
在水中的溶解度(g/100g水) |
互溶 |
0.914 |
1 |
7.5 |
互溶 |
请回答下列问题。
(1)加入药品之前须做的操作是:_________________,实验进行的途中若发现未加入碎瓷片,其处理的方法是__________________。
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是_____________。温度计的温度应控制在_____________之间。
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是___________,______________,此操作可在___________(填写玻璃仪器名称)中进行,同时进行分离。
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了_______________________。
(5)粗产品中含有的主要有机液体杂质是_____________,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行______________操作。
查看习题详情和答案>>
| |||||||||||||||
如右图是中学实验中常用到的仪器。
 (1)该装置除用于洗气外,还有其它用途:医院给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装盛有水的该装置,用于_________,此时氧气应从_________口导入。
(1)该装置除用于洗气外,还有其它用途:医院给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装盛有水的该装置,用于_________,此时氧气应从_________口导入。
(2)若用该装置收集H2,H2应从_________端通入;若收集Cl2,Cl2应从_________端通入;若瓶中充满水,要收集O2,O2应从_________端通入。
(3)该装置既可以收集H2、Cl2、O2,还可适用于_________(必要时可盛适量液体,填序号)
a.制气 b.贮气 c.干燥
(4)实验室用MnO2与浓盐酸反应制Cl2的实验中,在将生成的Cl2通入NaOH溶液之前,先将Cl2从该装置___________________________________________
管口导入,此时该装置所起的作用是防止_______________________。
(5)在乙烯与溴水反应制二溴乙烷的实验中,能将此装置添加在制乙烯装置和加成反应装置之间,此时该装置的作用是_________。
(6)当用该装置收集NO时,应采取的主要操作步骤是____________________。
查看习题详情和答案>>Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。

(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有 ???????? 。
(2)反应后在装置C中可得NaClO2溶液。已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上右图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤: ① 蒸发结晶;② ??????????? ;③ 洗涤;④ 干燥。
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:① 准确量取ClO2溶液V1mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0。② 加入足量的KI晶体,静置片刻。此时发生反应的离子方程式为:????????????? ;③ 加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL。则原ClO2溶液的浓度为????????? mol/L(用含字母的代数式表示)。(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl- 组合形成的三种强电解质溶液,分别装入下图装置
中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。

接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式?????????????????????????????????????? ;
(2)电极f上发生的电极反应为????????????????????????????? ;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是??????????????????????????????????? 。
查看习题详情和答案>>