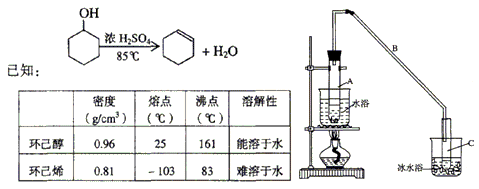
题目内容
| |||||||||||||||
解析:
(1) |
①防暴沸,冷凝;②防止环己烯挥发 |
(2) |
①上层,C;②g,冷却水与气体形成逆流;③83℃,B |

 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
| |||||||||||||||||||||||||||||||||
考生注意:此题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
(A)四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 | A | B | C | D. |
| 性质或结构信息 | 室温下单质呈粉末状固体,加热易熔化。 单质在氧气中燃烧,发出明亮的蓝紫色火焰。 | 单质常温、常压下是气体,能溶于水。 原子的M层上有1个未成对的p电子。 | 单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 | 原子最外电子层上s电子数等于p电子数 单质为空间网状晶体,具有很高的熔、沸点。 |
(1)B元素在周期表中的位置是____________,写出A原子的电子排布式____________。
(2)写出C单质与水反应的化学方程式_____________________。A与C形成的化合物溶于水后,溶液的pH____________7(填“大于”“等于”或“小于”)。
(3)D元素最高价氧化物晶体的硬度__________(填“大”或“小”),其理由是____________________________________________________________________。
(4)A、B两元素非金属性较强的是(写元素符号)______________。写出能证明这一结论的一个实验事实________________________________________________________________。
(B)元素A―D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
| 元素 | A | B | C | D |
| 性质或结构信息 | 单质制成的高压灯,发出的黄光透雾力强、射程远 | 工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构。 | 单质常温、常压下是气体,原子的L层有一个未成对的p电子 | +2价阳离子的核外电子排布与氖原子相同 |
(1)上表中与A属于同一周期的元素是___________,写出D离子的电子排布式___________。
(2)D和C形成的化合物属于_______________晶体。
写出C单质与水反应的化学方程式_____________________________________________。
(3)对元素B的单质或化合物描述正确的是_______________。
a.B元素的最高正价为+6
b.常温、常压下单质难溶于水
c.单质分子中含有18个电子
d.在一定条件下镁条能与单质B反应
(4)A和D两元素金属性较强的是___________(写元素符号)。写出能证明该结论的一个实验事实__________________________________________________________________。
(A)四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
元素 | A | B | C | D. |
性质或结构信息 | 室温下单质呈粉末状固体,加热易熔化。 单质在氧气中燃烧,发出明亮的蓝紫色火焰。 | 单质常温、常压下是气体,能溶于水。 原子的M层上有1个未成对的p电子。 | 单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 | 原子最外电子层上s电子数等于p电子数 单质为空间网状晶体,具有很高的熔、沸点。 |
(1)B元素在周期表中的位置是____________,写出A原子的电子排布式____________。
(2)写出C单质与水反应的化学方程式_____________________。A与C形成的化合物溶于水后,溶液的pH____________7(填“大于”“等于”或“小于”)。
(3)D元素最高价氧化物晶体的硬度__________(填“大”或“小”),其理由是____________________________________________________________________。
(4)A、B两元素非金属性较强的是(写元素符号)______________。写出能证明这一结论的一个实验事实________________________________________________________________。
(B)元素A—D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
元素 | A | B | C | D |
性质或结构信息 | 单质制成的高压灯,发出的黄光透雾力强、射程远 | 工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构。 | 单质常温、常压下是气体,原子的L层有一个未成对的p电子 | +2价阳离子的核外电子排布与氖原子相同 |
(1)上表中与A属于同一周期的元素是___________,写出D离子的电子排布式___________。
(2)D和C形成的化合物属于_______________晶体。
写出C单质与水反应的化学方程式_____________________________________________。
(3)对元素B的单质或化合物描述正确的是_______________。
a.B元素的最高正价为+6
b.常温、常压下单质难溶于水
c.单质分子中含有18个电子
d.在一定条件下镁条能与单质B反应
(4)A和D两元素金属性较强的是___________(写元素符号)。写出能证明该结论的一个实验事实_____________________________________________________________________。
(A)如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。
![]()
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
1 | 10 mL FeSO4溶液 | 10 mL NH3 | 生成白色沉淀,后变色 |
2 | 20 mL H2S | 10 mL SO2 |
|
3 | 30 mL NO2(主要) | 10 mL H2O(l) | 剩有无色气体,活塞自动向内压缩 |
4 | 15 mL Cl2 | 40 mL NH3 |
|
试回答下列问题:
(1)实验1中,沉淀最终变为___________色,写出沉淀变色的化学方程式_______________。
(2)实验2甲针筒内的现象是:有________生成,活塞___________移动(填“向外”“向内”或“不”)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入__________溶液中。
(3)实验3中,甲中的30 mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是__________,写出NO2与H2O反应的化学方程式_______________________________。
(4)实验4中,已知:3Cl2+2NH3![]() N2+6HCl。甲针筒除活塞有移动、针筒内有白烟产生外,气体的颜色变化为___________,最后针筒内剩余气体的体积约为______________mL。
N2+6HCl。甲针筒除活塞有移动、针筒内有白烟产生外,气体的颜色变化为___________,最后针筒内剩余气体的体积约为______________mL。
(B)某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式
_____________________________________________________________________
_____________________________________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是________反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是____________________;乙的作用是_____________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是____________________________。集气瓶中收集到的气体的主要成分是______________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有__________。要除去该物质,可先在混合液中加入______________(填写字母)。
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过_____________(填实验操作名称)即可除去。