摘要:25.将等物质的量的Al2O3和Fe2O3溶于100mL盐酸中.而后逐渐滴加1mol/L的NaOH 溶液.当加入的NaOH的体积V1=50mL时.开始有沉淀析出.且沉淀量随NaOH的加入而逐渐增加,当NaOH的体积V2=650mL时.沉淀量达最大值,继续滴加NaOH时.沉淀量逐渐减少,当V3≥750mL时.沉淀量不再改变. (1)最初加入的50mLNaOH溶液的作用是 . (2)计算所用盐酸的浓度. (3)计算Al2O3和Fe2O3的物质的量.
网址:http://m.1010jiajiao.com/timu3_id_359968[举报]
将等物质的量的Al2O3和Fe2O3溶于100mL盐酸中,而后逐渐滴加1mol/L的NaOH溶液,当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH的加入而逐渐增加;当NaOH的体积V2=650mL时,沉淀量达最大值;继续滴加NaOH时,沉淀量逐渐减少;当V3≥750mL时,沉淀量不再改变.
(1)最初加入的50mL NaOH溶液的作用是________.
(2)计算所用盐酸的浓度.
(3)计算Al2O3和Fe2O3的物质的量.
查看习题详情和答案>>(附加题)短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外第三层电子数目比第一层多1个,C-比A元素的离子多1个电子层,D元素的原子核外第二层比第一层多2个电子.回答下列问题:
(1)A、B、C、D四种元素的名称分别是
(2)C-的结构示意图为
 ;D元素在周期表中的位置是
;D元素在周期表中的位置是
(3)元素D的气态氢化物的电子式为
 ,其分子的结构特点是具有
,其分子的结构特点是具有
(4)工业上冶炼单质A的化学方程式为
(5)工业上常用单质B冶炼难熔的金属,写出氧化铁和单质B在高温下反应的化学方程式
(6)若将单质A、B用导线连接插入到氢氧化钠溶液中可以组成原电池,则正极材料是
查看习题详情和答案>>
(1)A、B、C、D四种元素的名称分别是
镁
镁
、铝
铝
、氯
氯
、碳
碳
;(2)C-的结构示意图为


第二周期、ⅣA
第二周期、ⅣA
;(3)元素D的气态氢化物的电子式为


正四面体
正四面体
结构,在一定条件下该氢化物可与单质C发生取代反应,若将等物质的量的该氢化物与单质C混合,在一定条件下充分反应后,生成物中物质的量最大的是HCl
HCl
(用化学式填写);(4)工业上冶炼单质A的化学方程式为
MgCl2(熔融)
Mg+Cl2↑
| ||
MgCl2(熔融)
Mg+Cl2↑
;
| ||
(5)工业上常用单质B冶炼难熔的金属,写出氧化铁和单质B在高温下反应的化学方程式
Fe2O3+2Al
Al2O3+3Fe
| ||
Fe2O3+2Al
Al2O3+3Fe
,该反应属于
| ||
放热
放热
反应(填“放热”或“吸热”),若反应中有0.25mol氧化铁参加反应,则消耗B单质的质量是13.5g
13.5g
,反应中转移电子的个数为9.03×1023
9.03×1023
;(6)若将单质A、B用导线连接插入到氢氧化钠溶液中可以组成原电池,则正极材料是
Mg
Mg
(用化学式填写),负极电极反应是2Al-6e-+8OH-=2AlO2-+3H2↑
2Al-6e-+8OH-=2AlO2-+3H2↑
.氯化钙常用于道路融冰剂和干燥剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al2O3、Fe2O3等杂质)制备氯化钙的主要流程如下: 完成下列填空:
完成下列填空:
(1)上述使用的盐酸的物质的量浓度约为6.0mol/L,若用36.5%的盐酸(密度为1.2g/mL)配置6.0mol/L的盐酸100mL,所需的玻璃仪器有玻璃棒、量筒、胶头滴管、 ;需要量取36.5%的盐酸 mL;配制过程中,若其他操作都正确,下列操作会引起浓度偏小的是 。
| A.定容摇匀后发现液面低于刻度线 |
| B.定容时俯视容量瓶的刻度线 |
| C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作 |
| D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线 |
(3)步骤Ⅱ控制石灰水用量的目的是防止(用离子方程式表示): 。
(4)滤渣的主要成分有(写化学式) 。
(5)步骤Ⅴ所含的操作依次是 、 。
(6)制得的氯化钙可以通过如下步骤测定其纯度:
①称取5.5g无水氯化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ 、 ;⑤称量。若得到4.3g碳酸钙,则氯化钙的质量分数为 ;若实验操作规范而测定结果偏低,其原因是 。 查看习题详情和答案>>
氯化钙常用于道路融冰剂和干燥剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al2O3、Fe2O3等杂质)制备氯化钙的主要流程如下:
 完成下列填空:
完成下列填空:
(1)上述使用的盐酸的物质的量浓度约为6.0mol/L,若用36.5%的盐酸(密度为1.2g/mL)配置6.0mol/L的盐酸100mL,所需的玻璃仪器有玻璃棒、量筒、胶头滴管、 ;需要量取36.5%的盐酸 mL;配制过程中,若其他操作都正确,下列操作会引起浓度偏小的是 。
(2)步骤Ⅰ中有关反应的离子方程式有: 、 、 。
(3)步骤Ⅱ控制石灰水用量的目的是防止(用离子方程式表示): 。
(4)滤渣的主要成分有(写化学式) 。
(5)步骤Ⅴ所含的操作依次是 、 。
(6)制得的氯化钙可以通过如下步骤测定其纯度:
①称取5.5g无水氯化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ 、 ;⑤称量。若得到4.3g碳酸钙,则氯化钙的质量分数为 ;若实验操作规范而测定结果偏低,其原因是 。
 完成下列填空:
完成下列填空:(1)上述使用的盐酸的物质的量浓度约为6.0mol/L,若用36.5%的盐酸(密度为1.2g/mL)配置6.0mol/L的盐酸100mL,所需的玻璃仪器有玻璃棒、量筒、胶头滴管、 ;需要量取36.5%的盐酸 mL;配制过程中,若其他操作都正确,下列操作会引起浓度偏小的是 。
| A.定容摇匀后发现液面低于刻度线 |
| B.定容时俯视容量瓶的刻度线 |
| C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作 |
| D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线 |
(3)步骤Ⅱ控制石灰水用量的目的是防止(用离子方程式表示): 。
(4)滤渣的主要成分有(写化学式) 。
(5)步骤Ⅴ所含的操作依次是 、 。
(6)制得的氯化钙可以通过如下步骤测定其纯度:
①称取5.5g无水氯化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ 、 ;⑤称量。若得到4.3g碳酸钙,则氯化钙的质量分数为 ;若实验操作规范而测定结果偏低,其原因是 。
(2013?保定一模)重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂.实验室模拟工业生产重铬酸钾时用铬铁矿(主要成份为FeO?Cr2O3)、纯碱、烧碱、氯酸钾等为原料先制得铬酸钠(Na2CrO4),涉及的主要反应是6FeO?Cr2O3+24NaOH+7KClO3
12Na2CrO4+3Fe2O3+7KCl+12H2O,然后将铬酸钠转化为K2Cr2O7.其主要工艺如下:
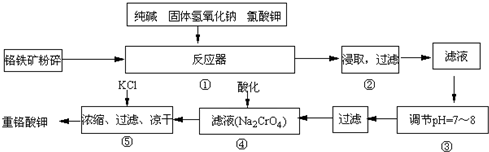
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:
(3)操作③的目的是什么,用简要的文字和化学方程式说明:
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4溶液和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定I2+2S2O32-=2I-+S4O62-.
①判断达到滴定终点的依据是:
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中的重铬酸钾的纯度为:
查看习题详情和答案>>
| ||

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
Al2O3+Na2CO3
2NaAlO2+CO2↑
| ||
Al2O3+Na2CO3
2NaAlO2+CO2↑
.
| ||
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:
NaFeO2+2H2O=Fe(OH)3↓+NaOH
NaFeO2+2H2O=Fe(OH)3↓+NaOH
.(3)操作③的目的是什么,用简要的文字和化学方程式说明:
由于硅酸钠和偏铝酸钠发生水解:SiO32-+2H2O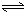 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O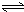 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O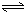 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O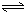 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
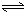 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O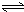 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O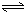 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O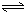 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全由于硅酸钠和偏铝酸钠发生水解:SiO32-+2H2O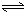 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O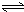 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O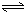 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O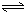 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
.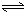 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O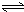 HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O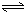 H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O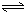 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
2CrO42-+2H+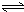 Cr2O72-+H2O
Cr2O72-+H2O
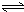 Cr2O72-+H2O
Cr2O72-+H2O2CrO42-+2H+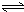 Cr2O72-+H2O
Cr2O72-+H2O
. Cr2O72-+H2O
Cr2O72-+H2O(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4溶液和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定I2+2S2O32-=2I-+S4O62-.
①判断达到滴定终点的依据是:
当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色
当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色
;②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中的重铬酸钾的纯度为:
94.08%
94.08%
(设K2Cr2O7的摩尔质量为294g?mol-1,整个过程中其它杂质不参与反应).