摘要:(实验提示:采用腹腔注射给药.给药剂量不作实验设计要求,给药1小时后.用注射器在小鼠膀胱处穿刺取尿液.)
网址:http://m.1010jiajiao.com/timu3_id_35983[举报]
“酸化”是化学实验中经常采用的方法,下列说法不正确的是( )
| A、提高高锰酸钾的氧化能力--用浓盐酸酸化 | B、确认溶液中是否舍有Ag+时--先加硝酸酸化,再加Cl-检验 | C、抑制硫酸铁的水解--用稀硫酸酸化 | D、确认溶液中是否含有SO42-时--先用盐酸酸化,再加Ba2+检验 |
我国硫酸工业SO2年排放量约10万吨,硫酸工业的尾气必须进行处理.
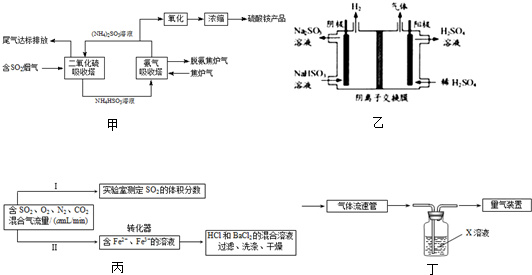
(1)某工厂采用氨-硫酸铵治理含硫烟气和同时吸收焦炉气中的氨,其工艺流程图如甲:
①从环境保护的角度看,采用上述工艺可防止
②氨气吸收塔中发生反应的离子方程式为
(2)用Na2SO3溶液吸收SO2,再用惰性电极电解吸收液将其转化为H2SO4的装置如图乙所示.阳极电极反应有两个,其电极反应式分别为:2H2O-4e-=O2+4H+和
(3)利用Fe3+的氧化性,将SO2氧化成SO42-而实现SO2的回收利用.为测定转化器中SO2氧化成SO42-的转化率,设计如图丙两个实验.
①实验Ⅰ可采用如图丁装置模拟测定烟气中SO2的体积分数.X溶液既要能吸收又要能指示反应终点,则X溶液最好选用
实验Ⅰ还可采用下列方案:取280mL(标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.020mol/L的K2Cr2O7溶液滴定反应生成的Fe2+,至终点消耗K2Cr2O7溶液25.00mL.尾气中SO2的体积分数为
已知:Cr2O72-+Fe2++H+→Cr3++Fe3++H2O(未配平).
②实验Ⅱ测定转化了的SO2,转化器中反应的离子方程式为
查看习题详情和答案>>

(1)某工厂采用氨-硫酸铵治理含硫烟气和同时吸收焦炉气中的氨,其工艺流程图如甲:
①从环境保护的角度看,采用上述工艺可防止
酸雨的产生、水体氮富营养化
酸雨的产生、水体氮富营养化
;设计一个简单的实验方案,检验尾气中是否含有氨气:将湿润的红色石蕊试纸伸入尾气样品中,观察试纸是否变红
将湿润的红色石蕊试纸伸入尾气样品中,观察试纸是否变红
.②氨气吸收塔中发生反应的离子方程式为
HSO3-+NH3?H2O=SO32-+NH4++H2O(或:HSO3-+NH3=SO32-+NH4+)
HSO3-+NH3?H2O=SO32-+NH4++H2O(或:HSO3-+NH3=SO32-+NH4+)
.(2)用Na2SO3溶液吸收SO2,再用惰性电极电解吸收液将其转化为H2SO4的装置如图乙所示.阳极电极反应有两个,其电极反应式分别为:2H2O-4e-=O2+4H+和
HSO3--2e-+H2O=3H++SO42-
HSO3--2e-+H2O=3H++SO42-
.(3)利用Fe3+的氧化性,将SO2氧化成SO42-而实现SO2的回收利用.为测定转化器中SO2氧化成SO42-的转化率,设计如图丙两个实验.
①实验Ⅰ可采用如图丁装置模拟测定烟气中SO2的体积分数.X溶液既要能吸收又要能指示反应终点,则X溶液最好选用
碘的淀粉溶液(或酸性KMnO4溶液)
碘的淀粉溶液(或酸性KMnO4溶液)
.实验Ⅰ还可采用下列方案:取280mL(标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.020mol/L的K2Cr2O7溶液滴定反应生成的Fe2+,至终点消耗K2Cr2O7溶液25.00mL.尾气中SO2的体积分数为
12.00%
12.00%
.已知:Cr2O72-+Fe2++H+→Cr3++Fe3++H2O(未配平).
②实验Ⅱ测定转化了的SO2,转化器中反应的离子方程式为
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
;假设测定在标准状况下进行,且已知混合气体流速,该实验中还需测定的数据有:实验时间、BaSO4的质量
BaSO4的质量
.中学实验室里,在乙酸乙酯和乙酸丁酯的制备实验中都采用的操作是( )
| A、在铁圈上放置石棉网 | B、加原料时,首先向大试管中加入浓硫酸 | C、选用Na2CO3溶液提纯产物 | D、通过分液得到高纯度的酯 |