题目内容
我国硫酸工业SO2年排放量约10万吨,硫酸工业的尾气必须进行处理.
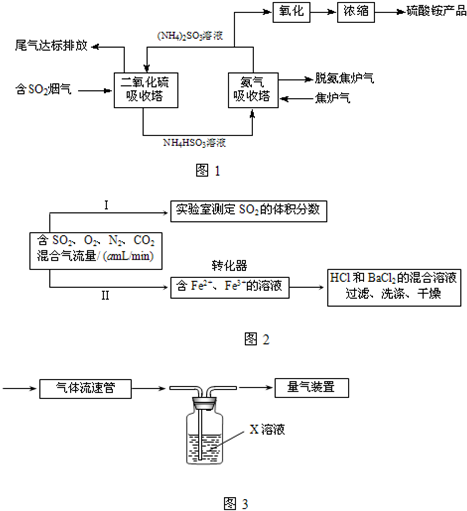
(1)某工厂采用氨-硫酸铵治理含硫烟气和同时吸收焦炉气中的氨,其工艺流程图如甲:
①从环境保护的角度看,采用上述工艺可防止
②氨气吸收塔中发生反应的离子方程式为
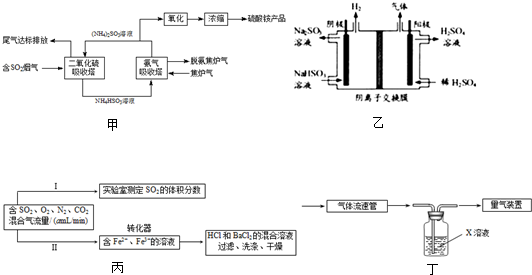
(2)用Na2SO3溶液吸收SO2,再用惰性电极电解吸收液将其转化为H2SO4的装置如图乙所示.阳极电极反应有两个,其电极反应式分别为:2H2O-4e-=O2+4H+和
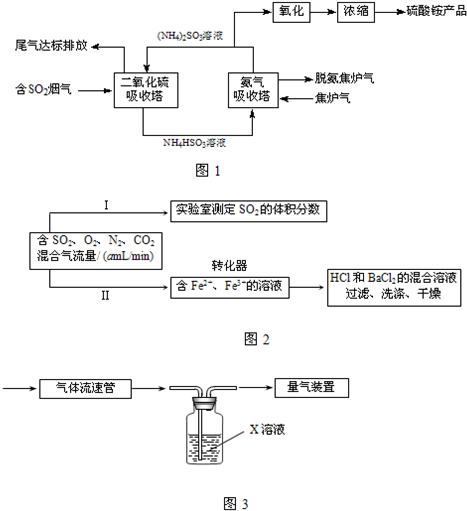
(3)利用Fe3+的氧化性,将SO2氧化成SO42-而实现SO2的回收利用.为测定转化器中SO2氧化成SO42-的转化率,设计如图丙两个实验.
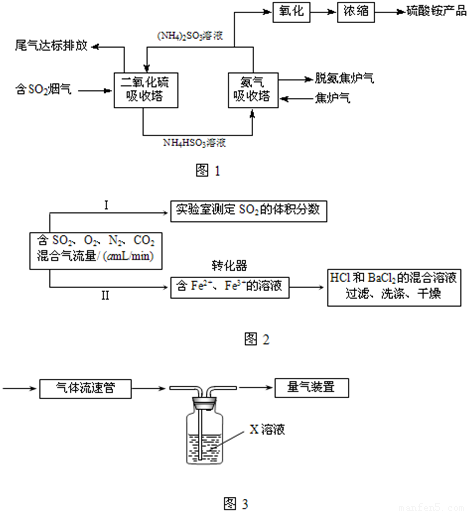
①实验Ⅰ可采用如图丁装置模拟测定烟气中SO2的体积分数.X溶液既要能吸收又要能指示反应终点,则X溶液最好选用
实验Ⅰ还可采用下列方案:取280mL(标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.020mol/L的K2Cr2O7溶液滴定反应生成的Fe2+,至终点消耗K2Cr2O7溶液25.00mL.尾气中SO2的体积分数为
已知:Cr2O72-+Fe2++H+→Cr3++Fe3++H2O(未配平).
②实验Ⅱ测定转化了的SO2,转化器中反应的离子方程式为

(1)某工厂采用氨-硫酸铵治理含硫烟气和同时吸收焦炉气中的氨,其工艺流程图如甲:
①从环境保护的角度看,采用上述工艺可防止
酸雨的产生、水体氮富营养化
酸雨的产生、水体氮富营养化
;设计一个简单的实验方案,检验尾气中是否含有氨气:将湿润的红色石蕊试纸伸入尾气样品中,观察试纸是否变红
将湿润的红色石蕊试纸伸入尾气样品中,观察试纸是否变红
.②氨气吸收塔中发生反应的离子方程式为
HSO3-+NH3?H2O=SO32-+NH4++H2O(或:HSO3-+NH3=SO32-+NH4+)
HSO3-+NH3?H2O=SO32-+NH4++H2O(或:HSO3-+NH3=SO32-+NH4+)
.(2)用Na2SO3溶液吸收SO2,再用惰性电极电解吸收液将其转化为H2SO4的装置如图乙所示.阳极电极反应有两个,其电极反应式分别为:2H2O-4e-=O2+4H+和
HSO3--2e-+H2O=3H++SO42-
HSO3--2e-+H2O=3H++SO42-
.(3)利用Fe3+的氧化性,将SO2氧化成SO42-而实现SO2的回收利用.为测定转化器中SO2氧化成SO42-的转化率,设计如图丙两个实验.
①实验Ⅰ可采用如图丁装置模拟测定烟气中SO2的体积分数.X溶液既要能吸收又要能指示反应终点,则X溶液最好选用
碘的淀粉溶液(或酸性KMnO4溶液)
碘的淀粉溶液(或酸性KMnO4溶液)
.实验Ⅰ还可采用下列方案:取280mL(标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.020mol/L的K2Cr2O7溶液滴定反应生成的Fe2+,至终点消耗K2Cr2O7溶液25.00mL.尾气中SO2的体积分数为
12.00%
12.00%
.已知:Cr2O72-+Fe2++H+→Cr3++Fe3++H2O(未配平).
②实验Ⅱ测定转化了的SO2,转化器中反应的离子方程式为
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
;假设测定在标准状况下进行,且已知混合气体流速,该实验中还需测定的数据有:实验时间、BaSO4的质量
BaSO4的质量
.分析:(1)①上述工艺吸收了含硫烟气和焦炉气中的氨,含硫烟气可引起酸雨的产生,氨可引起水体氮富营养化;根据氨气的检验方法:将湿润的红色石蕊试纸伸入尾气样品中,观察试纸是否变蓝;②NH4HSO3显酸性,能与碱性物质反应;
(2)在电解池的阳极上发生失电子的氧化反应;
(3)①测定模拟烟气中SO2的体积分数,可根据二氧化硫气体的还原性,与具有氧化性的酸性高锰酸钾或碘水反应,通过颜色的变化判断;根据原子守恒及电子转移列出关系式,根据关系式计算样品中SO2的体积分数;
②欲测定转化器中SO2氧化成SO42-的转化率,还需要测定时间和生成沉淀的质量.
(2)在电解池的阳极上发生失电子的氧化反应;
(3)①测定模拟烟气中SO2的体积分数,可根据二氧化硫气体的还原性,与具有氧化性的酸性高锰酸钾或碘水反应,通过颜色的变化判断;根据原子守恒及电子转移列出关系式,根据关系式计算样品中SO2的体积分数;
②欲测定转化器中SO2氧化成SO42-的转化率,还需要测定时间和生成沉淀的质量.
解答:解:(1)①含硫烟气中含有二氧化硫等有毒物质,可引起酸雨的产生,氨中含氮元素,可引起水体氮富营养化;因氨气是碱性气体,能使湿润的红色石蕊试纸变蓝,可以用来检验氨气的存在,
故答案为:酸雨的产生、水体氮富营养化;将湿润的红色石蕊试纸伸入尾气样品中,观察试纸是否变蓝;
②NH4HSO3显酸性,能与碱性物质氨气之间发生反应:NH4HSO3-+NH3?H2O═(NH4)2SO3+H2O,离子方程式为:HSO3-+NH3?H2O=SO32-+NH4++H2O,
故答案为:HSO3-+NH3?H2O=SO32-+NH4++H2O (或:HSO3-+NH3=SO32-+NH4+)
(2)装置的目的是用Na2SO3溶液吸收SO2,再用惰性电极电解吸收液将其转化为H2SO4,可以知道化合价升高的是硫元素,在阳极上会发生失电子化合价升高的反应,故阳极反应式为:HSO3--2e-+H2O=3H++SO42-,
故答案为:HSO3--2e-+H2O=3H++SO42-;
(3)①二氧化硫气体有还原性,与具有氧化性的酸性高锰酸钾或碘水反应,令样品中SO2的体积分数是x,则:
6SO2 ~12Fe2+~2Cr2O2-7
6mol 2mol
0.025L×0.020mol/L
=
解得x=12.00%,
故答案为:碘的淀粉溶液(或酸性KMnO4溶液);12.00%;
②转化器中二氧化硫可以被三价铁离子氧化为硫酸根离子,反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,欲测定转化器中SO2氧化成SO42-的转化率,还需要测定时间和生成沉淀的质量,根据硫酸钡沉淀的量计算硫酸根生成的量,据硫元素守恒没硫酸根离子的量即为被氧化的二氧化硫的量,进而计算转化率,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;BaSO4的质量.
故答案为:酸雨的产生、水体氮富营养化;将湿润的红色石蕊试纸伸入尾气样品中,观察试纸是否变蓝;
②NH4HSO3显酸性,能与碱性物质氨气之间发生反应:NH4HSO3-+NH3?H2O═(NH4)2SO3+H2O,离子方程式为:HSO3-+NH3?H2O=SO32-+NH4++H2O,
故答案为:HSO3-+NH3?H2O=SO32-+NH4++H2O (或:HSO3-+NH3=SO32-+NH4+)
(2)装置的目的是用Na2SO3溶液吸收SO2,再用惰性电极电解吸收液将其转化为H2SO4,可以知道化合价升高的是硫元素,在阳极上会发生失电子化合价升高的反应,故阳极反应式为:HSO3--2e-+H2O=3H++SO42-,
故答案为:HSO3--2e-+H2O=3H++SO42-;
(3)①二氧化硫气体有还原性,与具有氧化性的酸性高锰酸钾或碘水反应,令样品中SO2的体积分数是x,则:
6SO2 ~12Fe2+~2Cr2O2-7
6mol 2mol
| 0.280xL |
| 22.4L/mol |
| 6 | ||
|
| 2 |
| 0.025×0,02 |
解得x=12.00%,
故答案为:碘的淀粉溶液(或酸性KMnO4溶液);12.00%;
②转化器中二氧化硫可以被三价铁离子氧化为硫酸根离子,反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,欲测定转化器中SO2氧化成SO42-的转化率,还需要测定时间和生成沉淀的质量,根据硫酸钡沉淀的量计算硫酸根生成的量,据硫元素守恒没硫酸根离子的量即为被氧化的二氧化硫的量,进而计算转化率,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;BaSO4的质量.
点评:本题主要考查了SO2的性质及其计算,注意氧化还原反应规律以及电解池的工作原理是关键,难度大,综合性强.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目