摘要:35.在行车过程中.如果车距不够.刹车不及时.汽车将发生碰撞.车里的人可能受到伤害.为了尽可能地减轻碰撞引直怕伤害.人们设计了安全带.假定乘客质量为70 kg.汽车车速为108 km/h.从踩下刹车到车完全停止需要的时间为5 s.安全带对乘客的作用力大小约为( ). A.400N B.600N C.800N D.1000N
网址:http://m.1010jiajiao.com/timu3_id_35937[举报]
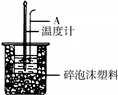 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.(1)烧杯间填满泡沫塑料的作用是
减少实验过程中的热量损失;
减少实验过程中的热量损失;
;(2)大烧杯上若不盖硬纸板,求得的中和热数值
偏小
偏小
(填“偏大”、“偏小”、“无影响”)(3)如下图所示,仪器A的名称是
环形玻璃棒
环形玻璃棒
;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H>
>
-57.3KJ/mol(填“>”、“<”或“=”);(4)实验中改用80mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量
不相等
不相等
(填“相等、“不相等”),所求中和热
相等
相等
(填“相等、“不相等”).(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会
偏小
偏小
;(均填“偏大”、“偏小”、“无影响”)(6)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
 本题由两部分组成
本题由两部分组成Ⅰ通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.?
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C | O=O |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 | 498 |
(1)比较下列两组物质的熔点高低(填“>”或“<”):SiC
>
>
Si;SiCl4<
<
SiO2.(2)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
| ||
+236
+236
kJ?mol-1.
(3)请把如图表示固体Si在O2中完全燃烧生成SiO2固体的能量变化图补充完整.
Ⅱ某实验小组设计下列实验
A 分别配制250mL 1.0mol/L盐酸跟和250mL 1.1mol/L氢氧化钠溶液.
B 每次分别取用上述配制的盐酸50mL跟和氢氧化钠50mL进行中和反应,并通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:?
(1)为进行A步实验时,有实验仪器托盘天平、药匙、小烧杯、玻璃棒、量筒、
250mL容量瓶(2个),还缺少的仪器有
胶头滴管
胶头滴管
进行B步实验时,有实验仪器大烧杯、小烧杯、量筒(2个)、小烧杯、塑料板、废纸条若干还缺少的实验仪器有环形玻璃搅拌棒和温度计
环形玻璃搅拌棒和温度计
.(2)在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H
偏大
偏大
(填“偏大”、“偏小”或“无影响”);(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.?
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1) /℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 31.8 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq);△H=-56.01kJ/mol
HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq);△H=-56.01kJ/mol
.?磺胺( 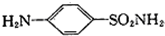 )是应用广泛的原料药及医药中间体,其合成路线如下:
)是应用广泛的原料药及医药中间体,其合成路线如下:
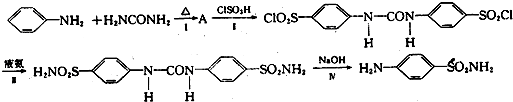
(1)在合成过程中,如果将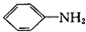 和H2NCONH2以2:1(物质的量之比,下同)反应则得到A,但如果以1:1反应则可以得到有机物B.
和H2NCONH2以2:1(物质的量之比,下同)反应则得到A,但如果以1:1反应则可以得到有机物B.
①写出A的结构简式 .
②B有多种同分异构体,符合下列要求的B的同分异构体有 种.
a.属于芳香族化合物;b.与银氨溶液反应有银镜生成;c.分子中苯环上有两种不同化学环境的氢原子.
(2)反应Ⅲ的反应类型是 .
(3)写出反应Ⅳ的化学方程式 .
(4)以己二胺[H2N(CH2)6NH2]和CH2=CH2为原料,其它无机试剂自选,以流程图形式表示合成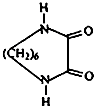 的过程.
的过程.
例:由乙醇合成聚乙烯的反应流程图可表示为:
CH3CH2OH
CH2=CH2
查看习题详情和答案>>
 )是应用广泛的原料药及医药中间体,其合成路线如下:
)是应用广泛的原料药及医药中间体,其合成路线如下:
(1)在合成过程中,如果将
 和H2NCONH2以2:1(物质的量之比,下同)反应则得到A,但如果以1:1反应则可以得到有机物B.
和H2NCONH2以2:1(物质的量之比,下同)反应则得到A,但如果以1:1反应则可以得到有机物B.①写出A的结构简式
②B有多种同分异构体,符合下列要求的B的同分异构体有
a.属于芳香族化合物;b.与银氨溶液反应有银镜生成;c.分子中苯环上有两种不同化学环境的氢原子.
(2)反应Ⅲ的反应类型是
(3)写出反应Ⅳ的化学方程式
(4)以己二胺[H2N(CH2)6NH2]和CH2=CH2为原料,其它无机试剂自选,以流程图形式表示合成
 的过程.
的过程.例:由乙醇合成聚乙烯的反应流程图可表示为:
CH3CH2OH
| 浓硫酸 |
| 170℃ |
| 催化剂 |
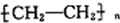
图1、图2为两套实验装置.
(1)写出下列仪器的名称:① ;② .
(2)仪器①~④中,使用时必须检查是否漏水的有 .(填序号)
(3)若利用图1装置制取蒸馏水,还缺少的仪器有 ,将仪器补充完整后进行的;实验操作的名称为: ,冷却水从 口进.
(4)现需配制1.0mol?L-1的NaOH溶液240mL,其中图2装置是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是 , .
(5)配制溶液时,一般可以分为以下几个步骤:①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为 .
(6)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图3.烧杯的实际质量为 g,该同学应称量 gNaOH.
(7)在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是 .
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线. 查看习题详情和答案>>

(1)写出下列仪器的名称:①
(2)仪器①~④中,使用时必须检查是否漏水的有
(3)若利用图1装置制取蒸馏水,还缺少的仪器有
(4)现需配制1.0mol?L-1的NaOH溶液240mL,其中图2装置是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是
(5)配制溶液时,一般可以分为以下几个步骤:①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为
(6)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图3.烧杯的实际质量为
(7)在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线. 查看习题详情和答案>>
(16分)50mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液在右图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热。
(1)烧杯间填满泡沫塑料的作用是 ;
(2)大烧杯上若不盖硬纸板,求得的中和热数值 (填“偏大”、 “偏小”、“无影响”)
(3)如下图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H -57.3KJ/mol(填“>”、“<”或“=”);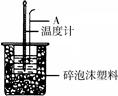
(4)实验中改用80mL 0.50mol/L盐酸跟100mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、“不相等”),
所求中和热 (填“相等、“不相等”) 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(均填“偏大”、“偏小”、“无影响”)
(6)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;