摘要:①x>1/3 SiO2 Si a(3x-1)/2 a(1-x)/2 ②x=1/3 Si a/3 ③1/3>x>1/4 Si SiC a(4x-1) a(1-3x) ④x<1/4 SiC C ax a(1-4x) ⑤x=1/4 SiC a/4
网址:http://m.1010jiajiao.com/timu3_id_358667[举报]
(5分)X、Y、Z是ⅠA--ⅦA族的三种非金属元素,它们在周期表中的位置如右图所示。试完成下列问题: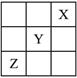
(1)X元素单质的化学式是__________。
(2)Y元素的原子结构示意图是__________,Y与Na所形成化合物的电子式为__________。
(3)Z元素的名称是__________,其价电子排布式为__________。
(5分)X、Y、Z是ⅠA--ⅦA族的三种非金属元素,它们在周期表中的位置如右图所示。试完成下列问题:

(1)X元素单质的化学式是__________。
(2)Y元素的原子结构示意图是__________,Y与Na所形成化合物的 电子式为__________。
(3)Z元素的名称是__________,其价电子排布式为__________。
查看习题详情和答案>>
(2013?淮南一模)从废钒催化剂(主要成分有V2O5,VOSO4,K2SO4,SiO2等)中回收V2O5的一种生产流程示意图如下,请回答下列问题:
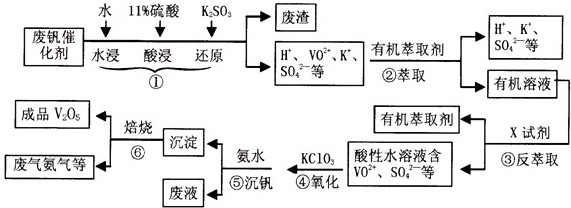
(1)步骤①中废渣的主要成分是
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是
(3)②③的变化过程可简化为(下式R表示VO 2+,HA表示有机萃取剂)
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
为提高②中萃取百分率,应采取的措施是
(4)请完成④中反应的离子方程式:
(5)25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如表
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH值为
(6)该工艺流程中,可以循环利用的物质有
查看习题详情和答案>>

(1)步骤①中废渣的主要成分是
SiO2
SiO2
,③中X试剂为H2SO4
H2SO4
;(均填化学式)(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是
打开分液漏斗瓶塞(或瓶塞凹槽对准瓶口小孔);当分液面接近(或略超过)活塞处时关闭活塞;上层液体从分液漏斗上口倒入另一烧杯中
打开分液漏斗瓶塞(或瓶塞凹槽对准瓶口小孔);当分液面接近(或略超过)活塞处时关闭活塞;上层液体从分液漏斗上口倒入另一烧杯中
;(3)②③的变化过程可简化为(下式R表示VO 2+,HA表示有机萃取剂)
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
为提高②中萃取百分率,应采取的措施是
加入碱中和硫酸使平衡正移
加入碱中和硫酸使平衡正移
;(4)请完成④中反应的离子方程式:
1
1
ClO3-+6
6
VO2++6
6
H-+=6
6
VO3++1Cl-
1Cl-
+3H2O
3H2O
(5)25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如表
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
1.7-1.8
1.7-1.8
;(6)该工艺流程中,可以循环利用的物质有
氨气 有机萃取剂
氨气 有机萃取剂
.某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
(1)体系中发生反应的化学方程式是
(2)列式计算该反应在0~3min时间内产物Z的平均反应速率:
(3)该反应达到平衡时反应物X的转化率α等于
(4)对于上述反应在维持其他条件不变的情况下只改变一种实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如图所示)则曲线1、2、3所对应的实验条件改变分别是:1
查看习题详情和答案>>
| tmin | Xmol | Ymol | Zmol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
X+2Y 2Z
2Z
 2Z
2ZX+2Y 2Z
2Z
; 2Z
2Z(2)列式计算该反应在0~3min时间内产物Z的平均反应速率:
0.083mol/(L?min)
0.083mol/(L?min)
;(3)该反应达到平衡时反应物X的转化率α等于
45%
45%
;
(4)对于上述反应在维持其他条件不变的情况下只改变一种实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如图所示)则曲线1、2、3所对应的实验条件改变分别是:1
升高温度
升高温度
,2加入催化剂
加入催化剂
,3增大压强
增大压强
.该反应的△H<
<
0(填“>”、“<”或“=”),判断理由是:曲线1表示升高温度Z平衡时物质的量减小,平衡逆向移动,
因此正反应为放热反应则有△H<0
因此正反应为放热反应则有△H<0
曲线1表示升高温度Z平衡时物质的量减小,平衡逆向移动,
因此正反应为放热反应则有△H<0
.因此正反应为放热反应则有△H<0
某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
(1)体系中发生反应的化学方程式是
(2)列式计算该反应在0~5min时间内产物Z的平均反应速率:
(3)该反应达到平衡时反应物X的转化率α等于
(4)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1

查看习题详情和答案>>
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |
X+2Y?2Z
X+2Y?2Z
;(2)列式计算该反应在0~5min时间内产物Z的平均反应速率:
0.014mol/L?min
0.014mol/L?min
;(3)该反应达到平衡时反应物X的转化率α等于
45%
45%
;(4)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1
升高温度
升高温度
,2使用合适催化剂
使用合适催化剂
,3增大压强
增大压强
.