网址:http://m.1010jiajiao.com/timu3_id_358430[举报]
 (2010?烟台一模)硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气
(2010?烟台一模)硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气中二氧化硫的体积分数设计了如下两个方案:
方案一:取标准状态下的空气V L(内含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g.
请回答:
(1)加入过量的氯化钡溶液的目的是
(2)过滤后,若在滤液中加入硫酸钠溶液,有白色沉淀产生,说明
(3)过滤后,一般要用蒸馏水洗涤沉淀2-3次,以除去附在沉淀上的可溶性物质.请说明应通过什么方法验证可溶物质是否已被除尽(要求:实验过程、使用的试剂、现象及结论)
方案二:如图所示,装置中反应管内装有碘的淀粉溶液.按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积.
(4)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2的含量
(5)反应管内碘的淀粉溶液可以用下列
A.NaOH溶液 B.酸性KMnO4溶液
C.Na2SO3溶液 D.BaCl2溶液
(6)研究小组经过讨论发现方案二的设计中有一个明显的缺陷影响了测定结果(不属于操作错误),你认为该缺陷是
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4 g 铜片和含0.2 moL溶质的18.4 mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止。(假定在此过程溶液体积不变)

(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:________________
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:_____
A.铁粉 ?????? B.钠 ???? ?? C.氯化钡溶液 ???????? D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度。他设计了如下二种方案来测定SO2的量:
方案① 将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
方案② 将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀。
经仔细分析后,发现有不合理之处,请填写下表(可以不填满):
序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
方案① |
|
|
|
方案② |
|
|
|
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000 mL,取20.00 mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是_______________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)_____________________________________________________。
查看习题详情和答案>>
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4 g铜片和含0.2 moL溶质的18.4 mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止。(假定在此过程溶液体积不变)
(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:________________
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:_____
| A.铁粉 | B.钠 | C.氯化钡溶液 | D.银粉 |
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度。他设计了如下二种方案来测定SO2的量:
方案① 将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
方案② 将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀。
经仔细分析后,发现有不合理之处,请填写下表(可以不填满):
| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | | | |
| 方案② | | | |
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000 mL,取20.00 mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是_______________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)_____________________________________________________。 查看习题详情和答案>>

(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:________________
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:_____
| A.铁粉 | B.钠 | C.氯化钡溶液 | D.银粉 |
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度。他设计了如下二种方案来测定SO2的量:
方案① 将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
方案② 将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀。
经仔细分析后,发现有不合理之处,请填写下表(可以不填满):
| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | | | |
| 方案② | | | |
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000 mL,取20.00 mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是_______________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)_____________________________________________________。
Ⅰ以下是有关SO2、Cl2的性质实验.
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.
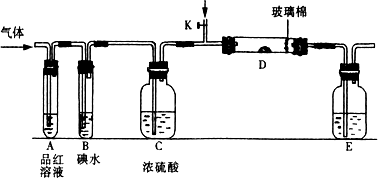
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?________(填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为________.
②SO2通入B中,溶液颜色退去,则该反应的离子方程式为________.
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母)________,仍然无法观察到沉淀产生.
A.氨水
B.稀盐酸
C.硝酸钾溶液
D.硫化钠溶液
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式________.
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.通入SO2的电极为________极,其电极反应式为________;电池的总反应式________

Ⅱ实验是化学研究的基础,关于下列各装置图的叙述正确的是________(填序号)
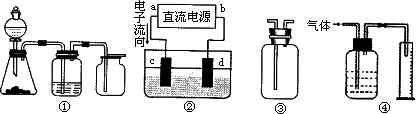
A.装置①可完成多种气体的发生、净化和收集,如铜屑与稀硝酸反应
B.装置②中,a为正扳,d为阳极
C.装置③可用于收集H2、NH3、Cl2,、HCl、NO2等
D.装置④能用于测量气体体积
Ⅲ用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是________(填序号)
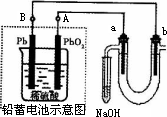
A.铅蓄电池负极的反应式为:Pb-2e-=Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br-